Với giải Luyện tập trang 53 Hóa học lớp 10 Chân trời sáng tạo chi tiết trong Bài 8: Quy tắc octet giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 10. Mời các bạn đón xem:
Giải bài tập Hóa học lớp 10 Bài 8: Quy tắc octet
Luyện tập trang 53 Hóa học 10: Nguyên tử của các nguyên tố hydrogen và fluorine có xu hướng cho đi, nhận thêm hay góp chung các electron hóa trị khi tham gia liên kết hình thành phân tử hydrogen fluoride (HF)?
Phương pháp giải:
- Nguyên tử fluorine và hydrogen đều là phi kim
+ Fluorine có 7 electron lớp ngoài cùng
+ Hydrogen có 1 electron lớp ngoài cùng (lớp 1 có tối đa 2 electron)
=> Cả 2 có xu hướng nhận electron để đạt cấu hình electron của khí hiếm
Lời giải:
- Nguyên tử fluorine và hydrogen đều là phi kim
+ Fluorine có 7 electron lớp ngoài cùng
+ Hydrogen có 1 electron lớp ngoài cùng (lớp 1 có tối đa 2 electron)
=> Cả 2 có xu hướng nhận electron để đạt cấu hình electron của khí hiếm
=> Khi tham gia liên kết hình thành phân tử HF, mỗi nguyên tử sẽ bỏ ra 1 electron để tạo thành 1 cặp electron dùng chung
Lý thuyết Quy tắc octet
- Quy tắc octet (bát tử): Trong quá trình hình thành liên kết hóa học, nguyên tử của các nguyên tố nhóm A có xu hướng tạo thành lớp vỏ ngoài cùng có 8 electron tương ứng với khí hiếm gần nhất (hoặc 2 electron với khí hiếm helium).
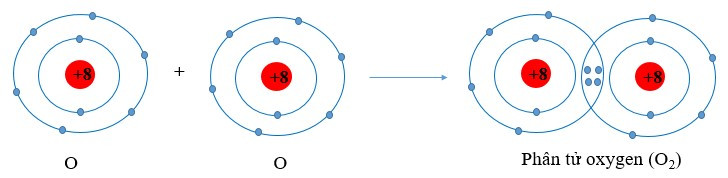
Ví dụ 1: Vận dụng quy tắc octet trong sự hình thành phân tử oxygen (O2)
Nguyên tử oxygen có 6 electron ở lớp ngoài cùng. Khi 2 nguyên tử O liên kết với nhau, mỗi nguyên tử O sẽ góp 2 electron để tạo 2 cặp electron dùng chung tạo thành cấu hình electron bền vững của khí hiếm neon.
Ví dụ 2: Vận dụng quy tắc octet trong sự tạo thành ion potassium (K+).
Nguyên tử potassium có 1 electron ở lớp ngoài cùng. Nếu mất đi 1 electron nguyên tử potassium sẽ đạt được cấu hình electron bền vững, giống với khí hiếm gần nhất là Ar.
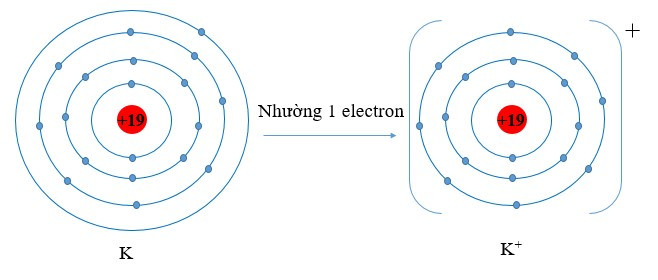
Viết gọn: K → K+ + 1e
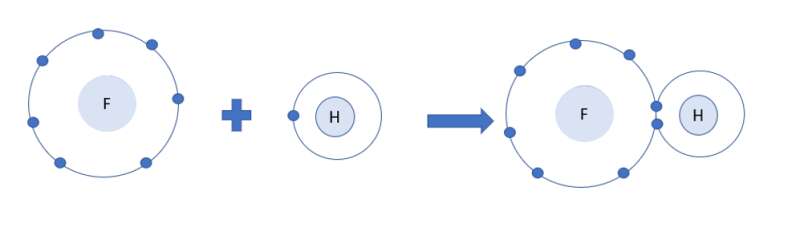
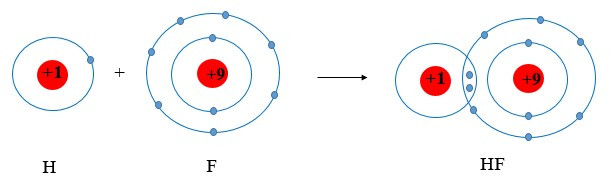
Ví dụ 3: Vận dụng quy tắc octet trong sự tạo thành phân tử HF.
+ Fluorine thuộc nhóm VIIA ⇒ có 7 electron lớp ngoài cùng.
+ Hydrogen thuộc nhóm IA ⇒ có 1 electron lớp ngoài cùng (lớp 1 có tối đa 2 electron)
⇒ Cả 2 có xu hướng nhận electron để đạt cấu hình electron của khí hiếm
⇒ Khi tham gia liên kết hình thành phân tử HF, mỗi nguyên tử sẽ gọp chung 1 electron để tạo thành cặp electron dùng chung.
Chú ý:
+ Không phải mọi trường hợp, nguyên tử của các nguyên tố khi tham gia liên kết đều tuân theo quy tắc octet. Người ta nhận thấy, một số phân tử có thể không tuân theo quy tắc octet như: NO; BH3; SF6 …
+ Với nguyên tử của các nguyên tố nhóm B, người ta áp dụng một số quy tắc khác, tương ứng với quy tắc octet, là quy tắc 18 electron để giải thích xu hướng khi tham gia liên kết hóa học của chúng.
Xem thêm lời giải bài tập Hóa học 10 Chân trời sáng tạo hay, chi tiết khác:
Xem thêm các bài giải SGK Hóa học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Bài 7: Định luật tuần hoàn - Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học