Tailieumoi.vn xin giới thiệu Trắc nghiệm Hóa học lớp 12 Bài 14: Tính chất hoá học của kim loại sách Cánh diều. Bài viết gồm 15 câu hỏi trắc nghiệm với đầy đủ các mức độ và có hướng dẫn giải chi tiết sẽ giúp học sinh ôn luyện kiến thức và rèn luyện kĩ năng làm bài trắc nghiệm Hóa học 12. Ngoài ra, bài viết còn có phần tóm tắt nội dung chính lý thuyết Bài 14: Tính chất hoá học của kim loại. Mời các bạn đón xem:
Trắc nghiệm Hóa học 12 Bài 14: Tính chất hoá học của kim loại
Phần 1. Trắc nghiệm Tính chất hoá học của kim loại
Phần I. Câu trắc nghiệm nhiều phương án lựa chọn. Mỗi câu hỏi chỉ chọn một phương án trả lời.
Câu 1: Cho bột Fe vào dung dịch AgNO3 và Cu(NO3)2. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch X gồm hai muối và chất rắn Y gồm hai kim loại. Hai muối trong X và hai kim loại trong Y lần lượt là
A. Cu(NO3)2; Fe(NO3)2 và Cu; Fe.
B. Cu(NO3)2; Fe(NO3)2 và Ag, Cu.
C. Fe(NO3)2; Fe(NO3)3 và Cu, Ag.
D. Cu(NO3)2; AgNO3 và Cu, Ag.
Đáp án đúng là: B
Thứ tự phản ứng:
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag
Fe + Cu(NO3)2 → Fe(NO3)2 + Cu
Vậy 2 kim loại thu được sau phản ứng là: Ag, Cu.
Dung dịch X gồm hai muối là: Cu(NO3)2 dư; Fe(NO3)2.
Câu 2: Cho 0,02 mol Na vào 1 000 mL dung dịch chứa CuSO4 0,05 M và H2SO4 0,005M. Hiện tượng của thí nghiệm trên là
A. có bọt khí bay lên và có kết tủa màu xanh lam.
B. chỉ có khí bay lên.
C. chỉ có kết tủa xanh lam.
D. có khí bay lên và có kết tủa sau đó kết tủa tan.
Đáp án đúng là: A
nNa = 0,02 mol;
2Na + 2H2O → 2NaOH + H2↑
0,02 0,02 0,01 mol
2NaOH + H2SO4 → Na2SO4 + 2H2O
0,01 ← 0,005 mol
2NaOH + CuSO4 → Cu(OH)2 ↓ + Na2SO4
0,01 0,05 0,005mol
Vậy hiện tượng của thí nghiệm là: có bọt khí bay lên và có kết tủa màu xanh lam.
Câu 3: Kẽm khử được cation kim loại trong dãy muối nào dưới đây?
A. Cu(NO3)2, Pb(NO3)2, Ni(NO3)2.
B. AlCl3, MgCl2, Pb(NO3)2.
C. AlCl3, Ni(NO3)2, Pb(NO3)2.
D. MgCl2, NaCl, Cu(NO3)2.
Đáp án đúng là: A
Dựa vào dãy điện hóa xác định được kẽm khử được cation kim loại trong dãy muối: Cu(NO3)2, Pb(NO3)2, Ni(NO3)2.
Câu 4: Cho 0,35 mol hỗn hợp X gồm Cl2 và O2 phản ứng vừa đủ với 11,1 gam hỗn hợp Y gồm Mg và Al, thu được 30,1 gam hỗn hợp Z. Phần trăm khối lượng của Al trong Y là
A. 75,68%.
B. 24,32%.
C. 51,35%.
D. 48,65%.
Đáp án đúng là: B
Câu 5: Tiến hành 2 thí nghiệm sau:
- Thí nghiệm 1: cho m gam bột Fe (dư) vào V1 lít dung dịch Cu(NO3)2 1M.
- Thí nghiệm 2: cho m gam bột Fe (dư) vào V2 lít dung dịch AgNO3 0,1M.
Sau khi các phản ứng xảy ra hoàn toàn, khối lượng chất rắn thu được ở hai thí nghiệm đều bằng nhau. Giá trị của V1 so với V2 là
A. V1 = V2.
B. V1 =10V2.
C. V1 = 5V2.
D. V1 = 2V2.
Đáp án đúng là: A
Thí nghiệm 1
Fedư + Cu(NO3)2 → Fe(NO3)2 + Cu
V1 ← V1 →V1
⇒ ∆mtăng = 64V1 – 56V1 = 8V1 (1)
Thí nghiệm 2:
Fedư + 2AgNO3 → Fe(NO3)2 + 2Ag
0,05V2 ← 0,1V2 → 0,1V2
⇒ ∆mtăng = 0,1V2 .108 – 0,05V2.56 = 8V2 (2)
Từ (1) (2) có: V1 = V2
Câu 6. Kim loại nào sau đây không phản ứng với dung dịch HCl loãng?
A. Đồng.
B. Calcium.
C. Magnesium.
D. Kẽm.
Đáp án đúng là: A
Kim loại không phản ứng với dung dịch HCl loãng là đồng (copper, Cu).
Câu 7. Cho dãy các kim loại sau: K, Ca, Mg, Fe, Cu. Số kim loại trong dãy có khả năng tác dụng với nước ở điều kiện thường là
A. 5.
B. 4.
C. 3.
D. 2.
Đáp án đúng là: D
Kim loại trong dãy có khả năng tác dụng với nước ở điều kiện thường là K, Ca; kim loại Mg tác dụng với nước nóng, kim loại Fe tác dụng với hơi nước ở nhiệt độ cao và kim loại Cu không tác dụng với nước.
Câu 8. Cặp chất không xảy ra phản ứng hoá học là
A. Cu và dung dịch FeCl3.
B. Fe và dung dịch HCl.
C. Fe và dung dịch FeCl3.
D. Cu và dung dịch FeCl2.
Đáp án đúng là: D
Do cặp Cu2+/Cu đứng sau cặp Fe2+/Fe nên Cu không phản ứng được với FeCl2.
Câu 9. Một mẫu kim loại Cu có lẫn tạp chất là các kim loại Al, Mg. Để loại bỏ tạp chất thì dùng dung dịch nào sau đây?
A. NaOH.
B. Cu(NO3)2.
C. Fe(NO3)3.
D. Fe(NO3)2.
Đáp án đúng là: B
Để loại bỏ tạp chất ta dùng dung dịch Cu(NO3)2:
Mg + Cu(NO3)2 → Mg(NO3)2 + Cu
2Al + 3Cu(NO3)2 → 2Al(NO3)3 + 3Cu
Dùng NaOH ta chỉ bỏ được Al; dùng Fe(NO3)3 sẽ hòa tan cả 3 kim loại; dùng Fe(NO3)2 thì loại bỏ được Mg, Al nhưng lại bị lẫn Fe.
Câu 10. Các kim loại đều tác dụng được với dung dịch HCl nhưng không tác dụng với dung dịch HNO3 đặc, nguội?
A. Fe, Mg, Al.
B. Cu, Fe, Al.
C. Cu, Pb, Ag.
D. Fe, Al, Cr.
Đáp án đúng là: D
Kim loại Fe, Al, Cr đứng trước H trong dãy điện hóa nên tác dụng với dung dịch HCl nhưng đều không tác dụng với dung dịch HNO3 đặc, nguội (bị thụ động hóa trong HNO3 đặc nguội).
Phần II. Câu trắc nghiệm đúng sai. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai. (Đ – S).
Câu 11. Cho các nhận định sau về tính chất hóa học của kim loại.
a) Kim loại sắt (dư) cháy trong khí chlorine chỉ tạo một muối.
b) Kim loại nhôm có thể tan trong dung dịch kiềm.
c) Nhúng thanh Zn vào dung dịch CuSO4 thì khối lượng thanh Zn tăng.
d) Kim loại Al, Fe đều không tan trong dung dịch H2SO4 đặc, nguội.
a – Đúng. Kim loại sắt (dư) cháy trong khí chlorine chỉ tạo một muối.
b – Đúng. Kim loại nhôm có thể tan trong dung dịch kiềm.
c – Sai. Nhúng thanh Zn vào dung dịch CuSO4 thì khối lượng thanh Zn giảm.
d – Đúng. Kim loại Al, Fe đều không tan trong dung dịch H2SO4 đặc, nguội.
Câu 12. Cho một mẩu sodium nhỏ vào cốc nước có chứa vài giọt dung dịch phenolphtalein.
a) Sodium bị hoà tan nhanh chóng và xuất hiện bọt khí không màu.
b) Cốc nước chuyển từ không màu sang màu xanh.
c) Khí thoát ra trong thí nghiệm là một chất khí nhẹ hơn không khí; không cháy.
d) Nếu thay mẩu sodium bằng mẩu potassium thì hiện tượng xảy ra tương tự.
Phản ứng: 2Na + 2H2O → 2NaOH + H2
a. Đúng.
b. Sai vì dung dịch thu được NaOH làm phenophtalein chuyển sang màu hồng.
c. Sai vì 2H2 + O2 → 2H2O; H2 cháy với ngọn lửa màu xanh nhạt.
d. Đúng vì 2K + 2H2O → 2KOH + H2.
Phần III. Câu trắc nghiệm yêu cầu trả lời ngắn
Câu 13. Tiến hành các thí nghiệm sau:
(1) Cho Mg vào lượng dư dung dịch FeCl3.
(2) Cho Ba vào lượng dư dung dịch CuSO4.
(3) Cho Zn vào dung dịch CuSO4.
(4) Cho dung dịch Fe(NO3)2 vào dung dịch AgNO3.
Số thí nghiệm thu được kim loại là?
Đáp án đúng là: 2
(1). Mg + 2FeCl3 dư → FeCl2 + 2MgCl2
⇒ Không thu được kim loại.
(2) Ba + 2H2O → Ba(OH)2 + H2
Ba(OH)2 + CuSO4 → BaSO4↓ + Cu(OH)2↓
⇒ Không thu được kim loại.
(3) Zn + CuSO4 → ZnSO4 + Cu
⇒ Thu được kim loại Cu.
(4) AgNO3 + Fe(NO3)2 → Fe(NO3)3 + Ag ↓
⇒ Thu được kim loại Ag.
Câu 14: Cho m gam hỗn hợp X gồm Mg và Zn vào dung dịch H2SO4 loãng, dư thu được 0,7437 lít H2 ( đkc). Khi cho m gam hỗn hợp X vào 200 mL dung dịch CuSO4 0,2M thì thu được bao nhiêu gam kết tủa?
Đáp án đúng là: 1,92 gam
Giải thích:
Mg + CuSO4 → MgSO4 + Cu (1)
nMg → nMg
Zn + CuSO4 → ZnSO4 + Cu (2)
nZn →nZn
Từ (1) (2) có: nCu = nMg + nZn = 0,03 mol
⇒ mCu = 0,03.64 = 1,92 gam.
Câu 15: Hoà tan hoàn toàn 10,4 gam hỗn hợp Mg, Al và Zn trong dung dịch HCl dư, thu được 7,437 lít khí H2 (đkc) và dung dịch chứa m gam muối. Giá trị của m là bao nhiêu?
Đáp án đúng là: 31,7.
Giải thích:
m muối = mKL + mCl- = 10,4 + 0,6.35,5 = 31,7 gam.
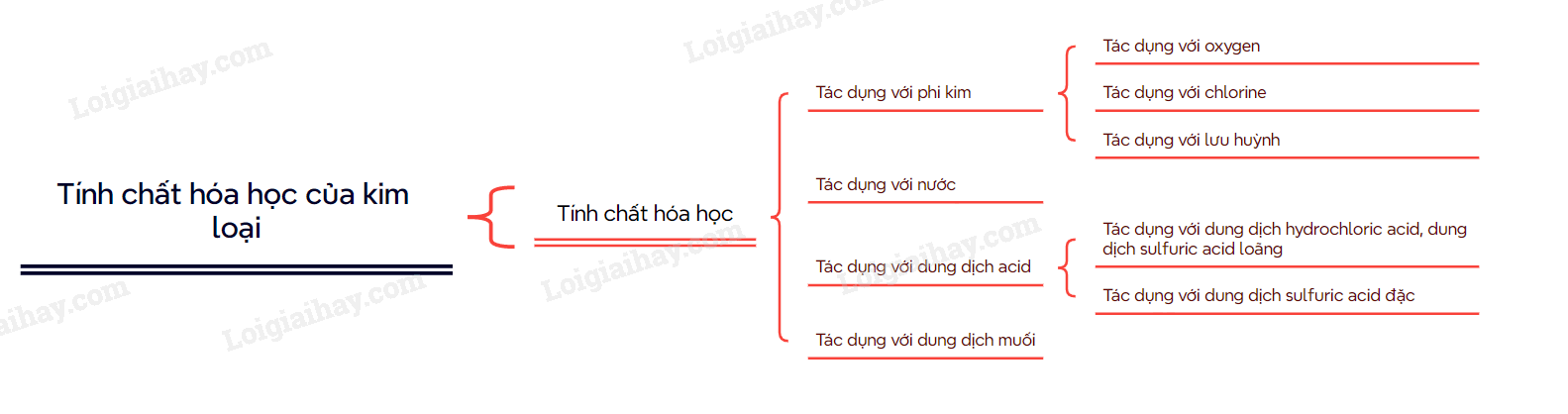
Phần 2. Lý thuyết Tính chất hoá học của kim loại
I. Tác dụng với phi kim
Nhiều kim loại tác dụng được với các phi kim như oxygen, lưu huỳnh, halogen,…
Ví dụ:
II. Tác dụng với nước
Trong môi trường trung tính, có:
2H2O + 2e H2 + OH- với E2H2O/2OH-+H2 = -0,413V
Cặp oxi hóa – khử Mn+/M có giá trị thế điện cực chuẩn nhỏ hơn – 0,413V thì kim loại M có thể tác dụng với nước ở nhiệt độ thường tạo thành hydroxide và khí hydrogen
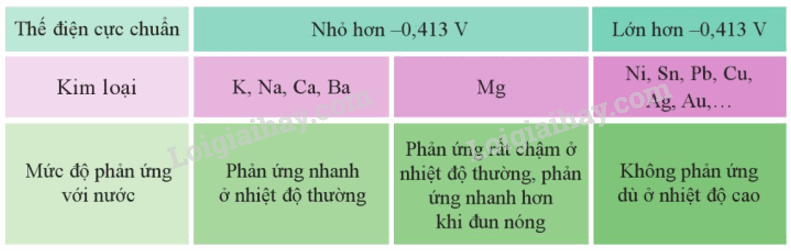
III. Tác dụng với dung dịch muối
Kim loại không tan trong nước và có giá trị thế điện cực chuẩn nhỏ hơn thường tác dụng được với dung dịch muối của kim loại có giá trị thế điện cực lớn hơn ở điều kiện chuẩn.
Ví dụ: Zn(s) + CuSO4(aq) ZnSO4(aq) + Cu(s)
IV. Tác dụng với dung dịch acid
1. Tác dụng với dung dịch hydrochloric acid, dung dịch sulfuric acid loãng
Do nên kim loại M có giá trị thế điện cực chuẩn có theẻ khử được ion H+ trong dung dịch hydrchloric acid hoặc dung dihcj sulfuric acid loãng, tạo thành khí H2
Ví dụ: Zn(s) + 2H+(aq) Zn2+ (aq) + H2(g)
Do giá trị thế điện cực chuẩn dương nên các kim loại như Cu, Ag,… không tác dụng với dung dịch hydrochloric acid hoặc dung dịch sulfuric acid loãng.
2. Tác dụng với dung dịch sulfuric acid đặc
Hầu hết các kim loại (trừ Au và Pt) phản ứng được với dung dịch sulfuric acid đặc. Phản ứng này thường tạo thành muối sulfate, nước và sulfur dioxide. Phản ứng diễn ra mạnh hơn khi hỗn hợp phản ứng được đun nóng
Ví dụ: 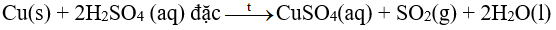
Sơ đồ tư duy Tính chất hóa học của kim loại
Xem thêm các bài Trắc nghiệm Hóa học 12 Cánh diều hay, chi tiết khác: