Tailieumoi.vn xin giới thiệu Trắc nghiệm Hóa học lớp 12 Bài 17: Nguyên tố nhóm IA sách Cánh diều. Bài viết gồm 15 câu hỏi trắc nghiệm với đầy đủ các mức độ và có hướng dẫn giải chi tiết sẽ giúp học sinh ôn luyện kiến thức và rèn luyện kĩ năng làm bài trắc nghiệm Hóa học 12. Ngoài ra, bài viết còn có phần tóm tắt nội dung chính lý thuyết Bài 17: Nguyên tố nhóm IA. Mời các bạn đón xem:
Trắc nghiệm Hóa học 12 Bài 17: Nguyên tố nhóm IA
Phần 1. Trắc nghiệm Nguyên tố nhóm IA
Phần I. Câu trắc nghiệm nhiều phương án lựa chọn. Mỗi câu hỏi chỉ chọn một phương án trả lời.
Câu 1: Tính khử của các kim loại nhóm IA từ Li đến Cs biến đổi như thế nào?
A. Tăng dần.
B. Không đổi.
C. Không có quy luật.
D. Giảm dần.
Đáp án đúng là: A
Tính khử của các kim loại nhóm IA từ Li đến Cs tăng dần.
Câu 2: Khi đốt nóng tinh thể LiCl trong ngọn lửa đèn khí không màu thì tạo ra ngọn lửa có màu
A. da cam.
B. tím nhạt.
C. vàng.
D. đỏ tía.
Đáp án đúng là: D
Khi đốt nóng tinh thể LiCl trong ngọn lửa đèn khí không màu thì tạo ra ngọn lửa có màu đỏ tía.
Câu 3: Các kim loại kiềm đều hoạt động hóa học mạnh. Vì vậy, để bảo quản lâu dài, chúng thường được ngâm trong
A. dầu hỏa.
B. nước máy.
C. ethyl alcohol.
D. giấm ăn.
Đáp án đúng là: A
Các kim loại kiềm đều hoạt động hóa học mạnh. Vì vậy, để bảo quản lâu dài, chúng thường được ngâm trong dầu hỏa.
Câu 4: Hợp chất nào sau đây vừa tác dụng được với dung dịch HCl, vừa tác dụng được với dung dịch NaOH?
A. NaHCO3.
B. NaCl.
C. Ba(OH)2.
D. Na2CO3.
Đáp án đúng là: A
NaHCO3 + HCl → NaCl + CO2 + H2O
NaHCO3 + NaOH → Na2CO3 + H2O
Câu 5: Khi so sánh nhóm IA với các nguyên tố khác trong cùng chu kỳ, nhận định nào sau đây không đúng?
A. Có tính khử mạnh nhất.
B. Có thế đến cực chuẩn âm nhất.
C. Có bán kính nguyên tử lớn nhất.
D. Có liên kết kim loại mạnh nhất.
Đáp án đúng là: D
Khi so sánh nhóm IA với các nguyên tố khác trong cùng chu kỳ, kim loại nhóm IA có liên kết kim loại yếu nhất.
Câu 6: Khi tham gia phản ứng hóa học, mỗi nguyên tử kim loại nhóm IA đều thể hiện khuynh hướng
A. nhường 2 electron.
B. nhận 2 electron.
C. nhận 1 electron.
D. nhường 1 electron.
Đáp án đúng là: D
Do có 1 electron ở lớp ngoài cùng nên khi tham gia phản ứng hóa học, mỗi nguyên tử kim loại nhóm IA đều thể hiện khuynh hướng nhường 1 electron.
Câu 7: Ở điều kiện thường các tinh thể kim loại nhóm IA đều có kiểu cấu trúc
A. lập phương tâm khối.
B. lập phương tâm mặt.
C. lục phương.
D. lập phương đơn giản.
Đáp án đúng là: A
Ở điều kiện thường các tinh thể kim loại nhóm IA đều có kiểu cấu trúc lập phương tâm khối.
Câu 8: Nhiệt độ nóng chảy của các kim loại nhóm IA từ Li đến Cs biến đổi như thế nào?
A. Tăng dần.
B. Không đổi.
C. Không có quy luật.
D. Giảm dần.
Đáp án đúng là: D
Nhiệt độ nóng chảy của các kim loại nhóm IA từ Li đến Cs biến đổi giảm dần.
Câu 9: Ở điều kiện thường kim loại có khối lượng riêng, nhỏ nhất là
A. K.
B. Rb.
C. Li.
D. Na.
Đáp án đúng là: C
Ở điều kiện thường kim loại Li có khối lượng riêng nhỏ nhất.
Câu 10: Nhận định nào sau đây về kim loại nhóm IA không đúng?
A. Độ cứng thấp.
B. Dễ nóng chảy.
C. Khối lượng riêng lớn.
D. Dẫn điện tốt.
Đáp án đúng là: C
Kim loại nhóm IA có khối lượng riêng nhỏ.
Phần II. Câu trắc nghiệm đúng sai. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai. (Đ – S)
Câu 11. Cho những phát biểu sau về kim loại kiềm và hợp chất của kim loại kiềm.
a) Thứ tự tính khử giảm dần của các kim loại kiềm là: Cs, Rb, K, Na, Li.
b) Phương pháp chung để điều chế kim loại kiềm là điện phân dung dịch.
c) Để bảo quản kim loại Na cần ngâm Na trong cồn tinh khiết.
d) Na2O tan trong nước tạo dung dịch trong suốt và thoát ra khí H2.
a) – đúng; đi từ dưới lên trên (Cs đến Li) tính khử kim loại giảm dần.
b) – sai; phải là điện phân nóng chảy.
c) – sai; Na tác dụng với cồn.
d) – sai; Na2O tác dụng với H2O chỉ sinh ra NaOH không có khí H2.
Câu 12. Sodium chloride (NaCl) là hợp chất hóa học được sử dụng rộng rãi trong nhiều lĩnh vực khác nhau, từ thực phẩm đến công nghiệp và y tế.
a) Sodium chloride là thành phần chính trong muối ăn.
b) Sodium chloride được sử dụng phổ biến như là đồ gia vị và chất bảo quản thực phẩm.
c) Việc sử dụng muối ăn NaCl sẽ giúp làm giảm bệnh bướu cổ.
d) Nồng độ muối cao có thể gây ra áp lực thẩm thấu lên vi sinh vật, làm chúng khó duy trì các hoạt động sống cần thiết do vậy có thể dùng NaCl để bảo quản thực phẩm.
a) Đúng.
b) Đúng.
c) Sai vì giúp ngăn ngừa bệnh bướu cổ là công dụng của iodine, ta phải thêm KI vào muối ăn.
d) Đúng.
Phần III. Câu trắc nghiệm yêu cầu trả lời ngắn
Câu 13: Tiến hành điện phân với điện cực trơ có màng ngăn 200 mL dung dịch NaCl cho tới khi cathode thoát ra 0,2479 L khí (đkc) thì ngừng điện phân. pH của dung dịch sau điện phân là bao nhiêu?
Đáp án đúng là: 13
Phương trình điện phân: 2NaCl + 2H2O 2NaOH + Cl2 + H2
Ở cực âm (cathode) thu được H2 và NaOH:
2H2O + 2e → H2 + 2OH-
Câu 14: Xét phản ứng nhiệt phân NaHCO3 thành Na2CO3 trong quá trình Solvay:
2NaHCO3 (s) → Na2CO3 (s) + CO2 (g) + H2O (g) ΔHo = +135,6kJ
Đáp án đúng là: 807,1 kJ.
Giải thích:
Nhiệt lượng cần cung cấp để nhiệt phân 1kg NaHCO3 theo phản ứng trên là
Câu 15: Ở 20oC, độ tan của NaCl trong nước là 35,9 g trong 100 g nước. Ở nhiệt độ này, dung dịch NaCl bão hòa có nồng độ a%.
Giá trị của a là bao nhiêu? (Làm tròn kết quả đến phần mười).
Đáp án đúng là: 26,4%
Giải thích:
Độ tan là khối lượng chất tan trong 100 gam dung môi (thường là nước) ở một nhiệt độ xác định.
Phần 2. Lý thuyết Nguyên tố nhóm IA
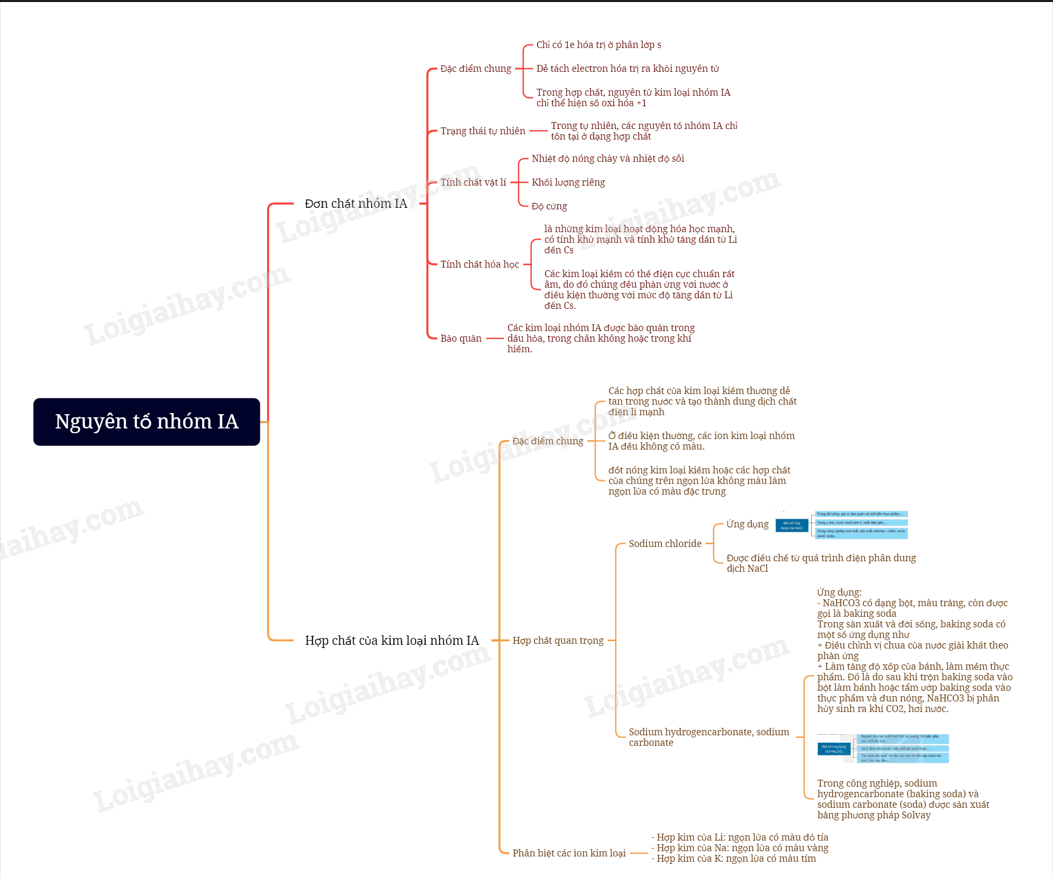
I. Trạng thái tự nhiên
- Nhóm IA gồm các nguyên tố lithium, sodium, potassium, rubidium, caesium và francium. Sodium và potassium phổ biến hơn các nguyên tố còn lại.
- Trong nước mặt, nước ngầm,… các nguyên tố sodium, potassium tồn tại ở dạng cation Na+ và K+
- Kim loại nhóm IA còn được gọi là các kim loại kiềm.
II. Đơn chất
1. Tính chất vật lí
a) Nhiệt độ nóng chảy và nhiệt độ sôi
Nhiệt độ sôi, nhiệt độ nóng chảy của kim loại kiềm có xu hướng giảm từ lithium đến caesium.
b) Khối lượng riêng và độ cứng
Các kim loại kiềm có khối lượng riêng nhỏ và độ cứng thấo hơn nhiều so với các kim loại nhóm khác. Các kim loại kiềm dễ được cắt nhỏ bởi dao, kéo.
2. Tính chất hóa học
a) Xu hướng chung
Do kim loại kiềm có giá trị rất nhỏ nên chúng có tính khử mạnh: M M+ + e
b) Tác dụng với nước, oxygen và chlorine
Các kim loại kiềm phản ứng mạnh với nước, oxygen, chlorine và nhiều chất oxi hóa khác,… Mức độ phản ứng của kim loại kiềm với chất oxi hóa tăng dần từ lithium đến caesium. Vì vậy:
+ Trong tự nhiên, các nguyên tố nhóm IA chỉ tồn tại dạng hợp chất.
+ Các kim loại kiềm được bảo quản bằng cách ngâm trong dầu hỏa khan hoặc trong bình khí hiếm.
III. Hợp chất
1. Khả năng hòa tan trong nước
Ở điều kiện thường, đa số các hợp chất của kim loại kiềm tan tốt trong nước.
2. Một số hợp chất quan trọng
a) Sodium chloride
- Sodium chloride được dùng trong chế biến và bảo quản nthực phẩm, làm nguyên liệu chính của quy trình trong công nghiệp chlorine – kiềm.
- Các sản phẩm của công nghiệp chlorine – kiềm có nhiều ứng dụng.
b) Sodium hydrogencarbonate, sodium carbonate
- Sodium hydrogencarbonate (NaHCO3)
+ NaHCO3 có dạng bột, màu trắng, còn được gọi là baking soda.
- Trong sản xuất và đời sống, baking soda có một số ứng dụng như
+ Điều chỉnh vị chua của nước giải khát theo phản ứng.
+ Làm tăng độ xốp của bánh, làm mềm thực phẩm. Đó là do sau khi trộn baking soda vào bột làm bánh hoặc tẩm ướp baking soda vào thực phẩm và đun nóng, NaHCO3 bị phân hủy sinh ra khí CO2, hơi nước.
- Sodium carbonate (Na2CO3)
+ Na2CO3 có dạng bột, màu trắng còn được gọi là soda.
+ Dung dịch soda có môi trường kiềm nên chất béo trong dầu, mỡ bị thủy phân trong dung dịch này. Do đó, soda được sử dụng để tẩy rửa dầu, mỡ bám trên các dụng cụ, thiết bị.
+ Soda thường được dùng để làm mềm nước cúng, làm nguyên liệu quan trọng trong sản xuất thủy tinh, giấy và nhiều hóa chất khác.
+ Lượng lớn soda được sản xuất thep phương pháp Solvay bằn cách cho khí CO2 vào dung dịch chứa sodium chloride bão hòa và ammonia.
3. Phân biệt các ion kim loại
Khi đốt các hợp chất của kim loại kiềm khác nhau trên ngọn lửa đèn khí sẽ thấy ngọn lửa có màu khác nhau:
- Hợp kim của Li: ngọn lửa có màu đỏ tía
- Hợp kim của Na: ngọn lửa có màu vàng
- Hợp kim của K: ngọn lửa có màu tím
Vì vậy, có thể nhận biết hoặc phân biệt các hợp chất của kim loại kiềm dựa vào màu ngọn lửa khi đốt chúng.
Sơ đồ tư duy Nguyên tố nhóm IA
Xem thêm các bài Trắc nghiệm Hóa học 12 Cánh diều hay, chi tiết khác: