Tailieumoi.vn xin giới thiệu Trắc nghiệm Hóa học lớp 12 Bài 24: Nguyên tố nhóm IA sách Kết nối tri thức. Bài viết gồm 15 câu hỏi trắc nghiệm với đầy đủ các mức độ và có hướng dẫn giải chi tiết sẽ giúp học sinh ôn luyện kiến thức và rèn luyện kĩ năng làm bài trắc nghiệm Hóa học 12. Ngoài ra, bài viết còn có phần tóm tắt nội dung chính lý thuyết Bài 24: Nguyên tố nhóm IA. Mời các bạn đón xem:
Trắc nghiệm Hóa học 12 Bài 24: Nguyên tố nhóm IA
Phần 1. Trắc nghiệm Nguyên tố nhóm IA
Câu 1. Có thể dùng NaOH (ở thể rắn) để làm khô các chất khí
A. NH3, O2, N2, CH4, H2.
B. N2, Cl2, O2, CO2, H2.
C. NH3, SO2, CO, Cl2.
D. N2, NO2, CO2, CH4, H2.
Đáp án đúng là: A
Có thể dùng NaOH (ở thể rắn) để làm khô các chất khí NH3, O2, N2, CH4, H2 vì các khí này đều không tác dụng với NaOH.
Câu 2. Trong một giai đoạn của quá trình Solvay có tồn tại cân bằng giữa các muối trong dung dịch: NaCl + NH4HCO3 ⇌ NaHCO3 + NH4Cl. Dựa trên tính chất nào của NaHCO3 để kết tinh muối này từ dung dịch hỗn hợp?
A. Độ tan thấp.
B. Tính lưỡng tính.
C. Độ bền nhiệt thấp.
D. Tính acid Bronsted.
Đáp án đúng là: A
Muối NaHCO3 có độ tan thấp nên có thể kết tinh muối này từ dung dịch hỗn hợp.
Câu 3. Cho 1,9 gam hỗn hợp gồm muối carbonate và hydrocarbonate của một kim loại kiềm. Tác dụng với dung dịch HCl dư thu được 0,496 lít khí (đkc). Kim loại kiềm là
A. K.
B. Li.
C. Na.
D. Rb.
Đáp án đúng là: C
Phương trình phản ứng hóa học xảy ra:
M2CO3 + 2HCl ⟶ 2MCl + CO2 + H2O
MHCO3 + HCl ⟶ MCl + CO2 + H2O
Từ 2 phương trình phản ứng trên ta nhận thấy số mol hỗn hợp muối carbonate và hydrocarbonate luôn bằng số mol CO2
Vậy M là Na (23).
Câu 4. Khi đốt nóng tinh thể LiCl trong ngọn lửa đèn khí không màu thì tạo ra ngọn lửa có màu
A. Da cam.
B. Tím nhạt.
C. Vàng.
D. Đỏ tía.
Đáp án đúng là: D
Khi đốt nóng tinh thể LiCl trong ngọn lửa đèn khí không màu thì tạo ra ngọn lửa có màu đỏ tía.
Câu 5. Ở điều kiện thường các tinh thể kim loại nhóm IA đều có kiểu cấu trúc nào?
A. Lập phương tâm khối.
B. Lập phương tâm mặt.
C. Lục phương.
D. Lập phương đơn giản.
Đáp án đúng là: A
Ở điều kiện thường các tinh thể kim loại nhóm IA đều có kiểu cấu trúc lập phương tâm khối.
Câu 6. Để bảo quản sodium, người ta phải ngâm sodium trong
A. nước.
B. ethanol.
C. dầu hỏa.
D. phenol lỏng.
Đáp án đúng là: D
Sodium không tác dụng với dầu hỏa nên có thể ngâm sodium trong dầu hỏa để ngăn nó bị oxi hóa do tiếp xúc với các chất khác từ môi trường.
Câu 7. Khi nhiệt phân hoàn toàn NaHCO3 thì sản phẩm của phản ứng nhiệt phân là
A. NaOH, CO2, H2.
B. Na2O, CO2, H2O.
C. Na2CO3, CO2, H2O.
D. NaOH, CO2, H2O.
Đáp án đúng là: C
Phương trình hóa học của phản ứng nhiệt phân:
2NaHCO3 Na2CO3 + CO2 + H2O.
Câu 8. Tính chất không phải của kim loại kiềm là
A. có số oxi hoá +1 trong các hợp chất.
B. có nhiệt độ nóng chảy thấp nhất trong tất cả kim loại.
C. kim loại kiềm có tính khử mạnh.
D. độ cứng cao.
Đáp án đúng là: D
Kim loại kiềm mềm, có thể cắt bằng dao.
Câu 9. Cấu hình electron của nguyên tử Na (Z = 11) là
A. 1s22s22p6 3s2.
B. 1s22s22p6.
C. 1s22s22p63s1.
D. 1s22s22p63s23p1.
Đáp án đúng là: C
Cấu hình electron của nguyên tử Na (Z = 11) là 1s22s22p63s1.
Câu 10. Trong hợp chất, nguyên tử nhóm IA thể hiện số oxi hóa
A. +1.
B. +1 và −7.
C. +2.
D. +1 và +2.
Đáp án đúng là: A
Trong hợp chất, nguyên tử nhóm IA chỉ thể hiện số oxi hóa +1.
Câu 11. Sodium chloride (NaCl) là hợp chất hóa học được sử dụng rộng rãi trong nhiều lĩnh vực khác nhau, từ thực phẩm đến công nghiệp và y tế.
a. Sodium chloride là thành phần chính trong muối ăn.
b. Sodium chloride được sử dụng phổ biến như là đồ gia vị và chất bảo quản thực phẩm.
c. Việc sử dụng muối ăn NaCl sẽ giúp làm giảm bệnh bướu cổ.
d. Nồng độ muối cao có thể gây ra áp lực thẩm thấu lên vi sinh vật, làm chúng khó duy trì các hoạt động sống cần thiết do vậy có thể dùng NaCl để bảo quản thực phẩm.
a. Đúng.
b. Đúng.
c. Sai vì giúp ngăn ngừa bệnh bướu cổ là công dụng của iodine, ta phải thêm KI vào muối ăn.
d. Đúng.
Câu 12. Thực hiện thí nghiệm: Đốt muối của một số kim loại kiềm
Bước 1: Lấy mẫu muối LiCl, NaCl và KCl cho vào các chén sứ có đánh số lần lượt là 1, 2, 3.
Bước 2: Cho khoảng 3−5 mL alcohol C2H5OH nguyên chất vào mỗi chén sứ.
Bước 3: Đốt cháy các mẫu muối trong chén sứ trên.
a. Sau bước 3, cả 3 chén đều cháy và cho các màu ngọn lửa khác nhau.
b. Sau bước 2 các mẫu muối tan một phần trong alcohol
c. Trình tự màu của 3 ngọn lửa lần lượt là: màu tím, màu vàng và màu đỏ tía.
d. Có thể dùng thí nghiệm này để nhận biết các hợp chất khác của hợp chất kim loại kiềm.
a. Đúng.
b. Đúng.
c. Sai vì trình tự màu của 3 ngọn lửa lần lượt là: màu đỏ tía, màu vàng và màu tím.
d. Sai vì thí nghiệm trên chỉ có thể cho biết sự hiện diện của ion kim loại kiềm, không giúp xác định loại hợp chất gì.
Câu 13. Hàn the là sodium tetraborate decahydrate có công thức Na2B4O7.10H2O thường được người dân dùng như một thứ phụ gia thực phẩm cho vào giò, bánh phở,… làm tăng tính dai và giòn. Từ năm 1985, tổ chức y tế thế giới đã cấm dùng hàn the vì nó rất độc, có thể gây co giật, trụy tim, hôn mê. Hàm lượng nguyên tố Na có trong hàn the là bao nhiêu phần trăm? (Làm tròn kết quả đến hàng phần mười).
Đáp số: 12.
Giải thích:
Câu 14. Ở 20oC, độ tan của NaCl trong nước là 35,9 g trong 100 g nước. Ở nhiệt độ này, dung dịch NaCl bão hòa có nồng độ a%. Giá trị của a là bao nhiêu? (Làm tròn kết quả đến hàng phần mười).
Đáp số: 26,4.
Giải thích:
Độ tan là khối lượng chất tan trong 100 gam dung môi (thường là nước).
Câu 15. Cho 0,078 gam K vào 189,924 gam nước, sau khi phản ứng hoàn toàn thu được m gam dung dịch. Tính giá trị của m?
Đáp số: 193.
Giải thích:
2K + 2H2O 2KOH + H2
0,002 0,001
Phần 2. Lý thuyết Nguyên tố nhóm IA
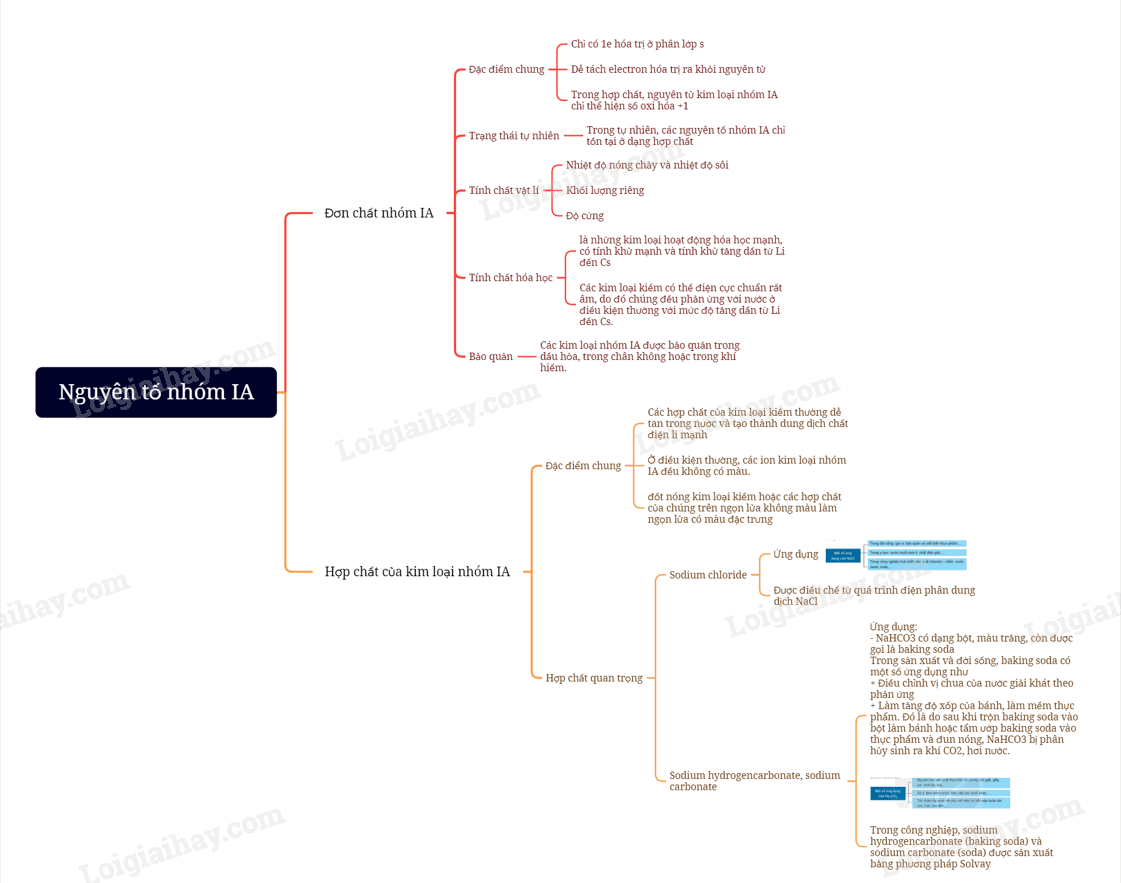
I. Đơn chất nhóm IA
1. Đặc điểm chung
- Nguyên tố nhóm IA là những nguyên tố s, chỉ có 1electron hóa trị ở phân lớp ns1 và đứng đầu mỗi chu kì tương ứng. Kim loai IA có thế điện cực chuẩn rất nhỏ, nên dễ tách electron hóa trị ra khỏi ngyên tử. Vì vậy, trong các phản ứng hóa học, chúng dễ nhường 1 electron, thể hiện tính khử rất mạnh
- Trong hợp chất, nguyên tử kim loại nhóm IA chỉ thể hiện số oxi hóa +1
2. Trạng thái tự nhiên
Trong tự nhiên, các nguyên tố nhóm IA chỉ tồn tại ở dạng hợp chất (chủ yếu là dạng muối). Sodium và potassium là hai nguyên tố phổ biến trong vỏ Trái Đất, có nhiều trong nước biển, mỏ muối, quặng halite (NaCl), quặng sylvinite (NaCl.KCl)
3. Tính chất vật lí
a) Nhiệt độ nóng chảy và nhiệt độ sôi
- Trong nhóm IA, nhiệt độ nóng chảy và nhiệt độ sôi của các kim loại có xu hướng giảm dần từ Li đến Cs
- Các kim loại nhosm IA đều dễ nóng chảy và có nhiệt độ nóng chảy thấp hơn so với các kim loại nhóm khác.
b) Khối lượng riêng
Các kim loại nhóm IA có khối lượng riêng nhỏ (đều là kim loại nhẹ) do có bán kính nguyên tử lớn và cấu trúc tính thể kém đặc khít
c) Độ cứng
Do có liên kết kim loại yếu nên các kim loại nhóm IA có độ cứng thấp (đều mềm, có thể cắt bằng dao, kéo)
4. Tính chất hóa học
- Kim loại kiềm là những kim loại hoạt động hóa học mạnh, có tính khử mạnh và tính khử tăng dần từ Li đến Cs
- Các kim loại kiềm có thế điện cực chuẩn rất âm, do đó chúng đều phản ứng với nước ở điều kiện thường với mức độ tăng dần từ Li đến Cs.
5. Bảo quản
Các kim loại nhóm IA được bảo quản trong dầu hỏa, trong chân không hoặc trong khí hiếm.
II. Hợp chất của kim loại nhóm IA
1. Đặc điểm chung
- Các hợp chất của kim loại kiềm thường dễ tan trong nước và tạo thành dung dịch chất điện li mạnh
- Ở điều kiện thường, các ion kim loại nhóm IA đều không có màu. Tuy nhiên, đốt nóng kim loại kiềm hoặc các hợp chất của chúng trên ngọn lửa không màu làm ngọn lửa có màu đặc trưng. Do vậy, có thể nhận biết hợp chất của kim loại nhóm IA bằng màu ngọn lửa.
2. Hợp chất quan trọng
a) Sodium chloride
- Ứng dụng:

- Quá trình điện phân dung dịch NaCl:
Trong công nghiệp chlorine – kiềm, quá trình điện phân dung dịch NaCl bão hòa có màng ngăn điện cực được ứng dụng để sản xuất xút công nghiệp (NaOH), khí chlorine (Cl2). Điện phân dung dịch NaCl bão hòa không có màng ngăn điện cực được ứng dụng để sản xuất nước Javel (NaClO)
b) Sodium hydrogencarbonate, sodium carbonate
- Ứng dụng
- NaHCO3 có dạng bột, màu trắng, còn được gọi là baking soda
Trong sản xuất và đời sống, baking soda có một số ứng dụng như
+ Điều chỉnh vị chua của nước giải khát theo phản ứng
+ Làm tăng độ xốp của bánh, làm mềm thực phẩm. Đó là do sau khi trộn baking soda vào bột làm bánh hoặc tẩm ướp baking soda vào thực phẩm và đun nóng, NaHCO3 bị phân hủy sinh ra khí CO2, hơi nước
- Sodium carbonate

- Sản xuất
Trong công nghiệp, sodium hydrogencarbonate (baking soda) và sodium carbonate (soda) được sản xuất bằng phương pháp Solvay từ nguyên liệu chính là đá vôi, muối ăn, ammonia và nước
Quá trình Solvay sản xuất soda gồm hai giai đoạn chính
+ Giai đoạn tạo NaHCO3: NaCl + NH3 + CO2 + H2O NaHCO3 + NH4Cl
Khi làm lạnh NaHCO3 kết tinh và được lọc, tách khỏi hệ phản ứng.
+ Giai đoạn tạo Na2CO3: 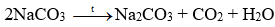
Sơ đồ tư duy Nguyên tố nhóm IA
Xem thêm các bài Trắc nghiệm Hóa học 12 Kết nối tri thức hay, chi tiết khác: