Với giải Câu hỏi 2 trang 132 Hóa học 12 Kết nối tri thức chi tiết trong Bài 27: Đại cương về kim loại chuyển tiếp dãy thứ nhất giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 12. Mời các bạn đón xem:
Giải bài tập Hóa học 12 Bài 27: Đại cương về kim loại chuyển tiếp dãy thứ nhất
Câu hỏi 2 trang 132 Hóa học 12: Từ cấu hình electron ở Bảng 27.1, xác định cấu hình electron của các ion kim loại sau: Cr3+, Mn2+, Cu2+.
Lời giải:
|
Ion |
Cr3+ |
Mn2+ |
Cu2+ |
|
Cấu hình electron |
[Ar]3d3 |
[Ar]3d5 |
[Ar]3d9 |
Lý thuyết Hợp chất của kim loại chuyển tiếp dãy thứ nhất
1. Số oxi hóa của nguyên tử kim loại chuyển tiếp dãy thứ nhất trong hợp chất.
- Do có nhiều electron hóa trị (ở phân lớp 4s và 3d) nên các nguyên tố chuyển tiếp dãy thứ nhất có khả năng tạo ra các hợp chất với nhiều trạng thái oxi hóa khác nhau.
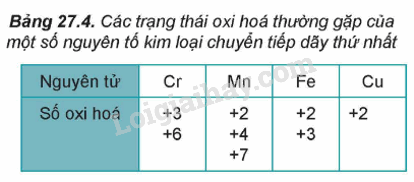
- Khi tham gia phản ứng hóa học, nguyên tử kim loại chuyển tiếp dãy thứ nhất ưu tiên nhường electron ở phân lớp 4s trước rồi đến electron ở phân lớp 3d, tạo thành các cation tương ứng.
2. Màu sắc của các ion kim loại chuyển tiếp dãy thứ nhất
Các ion kim loại chuyển tiếp dãy thứ nhất có màu sắc phong phú.
3. Chuẩn độ iron(II) sulfate bằng thuốc tím
- Trong phòng thí nghiệm, nồng độ iron(II) sulfate có thể được xác định bằng phương pháp chuẩn độ với dung dịch thuốc tím trong môi trường sulfuric theo phương trình hóa học
10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
4. Nhận biết một số ion kim loại chuyển tiếp
Trong hóa học, các ion kim loại chuyển tiếp thường được nhận biết dựa vào màu sắc đặc trưng của ion, của hợp chất ít tan hoặc của phức chất tương ứng.
Xem thêm lời giải bài tập Hóa học lớp 12 Kết nối tri thức hay, chi tiết khác:
Hoạt động thí nghiệm trang 133 Hóa học 12: Kiểm tra sự có mặt từng ion riêng biệt: Cu2+, Fe3+...
Xem thêm các bài giải bài tập Hóa Học lớp 12 Kết nối tri thức hay, chi tiết khác:
Bài 27. Đại cương về kim loại chuyển tiếp dãy thứ nhất