Với giải Hoạt động trang 112 Hóa học 12 Kết nối tri thức chi tiết trong Bài 24: Nguyên tố nhóm IA giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 12. Mời các bạn đón xem:
Giải bài tập Hóa học 12 Bài 24: Nguyên tố nhóm IA
Hoạt động trang 112 Hóa học 12: Phân biệt Li+, Na+, K+ bằng ngọn lửa (học sinh quan sát video thí nghiệm)
Hoá chất: các dung dịch bão hoà: LiCl, NaCl, KCl.
Dụng cụ: ống nghiệm, giá ống nghiệm, dây platinum (hoặc nickel); đèn khí Bunsen (khí gas).
Tiến hành:
- Nhúng dây platinum vào ống nghiệm chứa dung dịch LiCl bão hoà.
- Hơ nóng đầu dây trên ngọn lửa đèn khí.
- Tiến hành thí nghiệm tương tự với dung dịch NaCl bão hoà và dung dịch KCl bão hoà.
Quan sát hiện tượng xảy ra qua video thí nghiệm và thực hiện yêu cầu sau:
Nhận xét về màu ngọn lửa các ion kim loại trong thí nghiệm.
Lời giải:
Ở nhiệt độ thường, các ion kim loại nhóm IA đều không có màu. Tuy nhiên, đốt nóng hợp chất của chúng trên ngọn lửa không màu làm ngọn lửa có màu đặc trưng:
+ Hợp chất của Li: ngọn lửa có màu đỏ tía;
+ Hợp chất của Na: ngọn lửa có màu vàng;
+ Hợp chất của K: ngọn lửa có màu tím.
Lý thuyết Hợp chất của kim loại nhóm IA
1. Đặc điểm chung
- Các hợp chất của kim loại kiềm thường dễ tan trong nước và tạo thành dung dịch chất điện li mạnh
- Ở điều kiện thường, các ion kim loại nhóm IA đều không có màu. Tuy nhiên, đốt nóng kim loại kiềm hoặc các hợp chất của chúng trên ngọn lửa không màu làm ngọn lửa có màu đặc trưng. Do vậy, có thể nhận biết hợp chất của kim loại nhóm IA bằng màu ngọn lửa.
2. Hợp chất quan trọng
a) Sodium chloride
- Ứng dụng:

- Quá trình điện phân dung dịch NaCl:
Trong công nghiệp chlorine – kiềm, quá trình điện phân dung dịch NaCl bão hòa có màng ngăn điện cực được ứng dụng để sản xuất xút công nghiệp (NaOH), khí chlorine (Cl2). Điện phân dung dịch NaCl bão hòa không có màng ngăn điện cực được ứng dụng để sản xuất nước Javel (NaClO)
b) Sodium hydrogencarbonate, sodium carbonate
- Ứng dụng
- NaHCO3 có dạng bột, màu trắng, còn được gọi là baking soda
Trong sản xuất và đời sống, baking soda có một số ứng dụng như
+ Điều chỉnh vị chua của nước giải khát theo phản ứng
+ Làm tăng độ xốp của bánh, làm mềm thực phẩm. Đó là do sau khi trộn baking soda vào bột làm bánh hoặc tẩm ướp baking soda vào thực phẩm và đun nóng, NaHCO3 bị phân hủy sinh ra khí CO2, hơi nước
- Sodium carbonate

- Sản xuất
Trong công nghiệp, sodium hydrogencarbonate (baking soda) và sodium carbonate (soda) được sản xuất bằng phương pháp Solvay từ nguyên liệu chính là đá vôi, muối ăn, ammonia và nước
Quá trình Solvay sản xuất soda gồm hai giai đoạn chính
+ Giai đoạn tạo NaHCO3: NaCl + NH3 + CO2 + H2O NaHCO3 + NH4Cl
Khi làm lạnh NaHCO3 kết tinh và được lọc, tách khỏi hệ phản ứng.
+ Giai đoạn tạo Na2CO3: 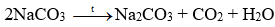
Xem thêm lời giải bài tập Hóa học lớp 12 Kết nối tri thức hay, chi tiết khác:
Hoạt động trang 111 Hóa học 12: Lithium, sodium, potassium tác dụng với nước, chlorine, oxygen...
Câu hỏi 2 trang 112 Hóa học 12: Trong phòng thí nghiệm:...
Câu hỏi 3 trang 112 Hóa học 12: a) Tại sao có thể bảo quản Na, K bằng cách ngâm trong dầu hoả?...
Hoạt động trang 114 Hóa học 12: Trong thực tiễn, sodium carbonate có một số ứng dụng....
Em có thể trang 115 Hóa học 12: Bảo quản kim loại kiềm đúng cách....
Xem thêm các bài giải bài tập Hóa Học lớp 12 Kết nối tri thức hay, chi tiết khác: