Với giải Luyện tập 3 trang 73 Hóa học lớp 12 Cánh diều chi tiết trong Bài 10: Thế điện cực chuẩn của kim loại giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 12. Mời các bạn đón xem:
Giải bài tập Hóa học 12 Bài 10: Thế điện cực chuẩn của kim loại
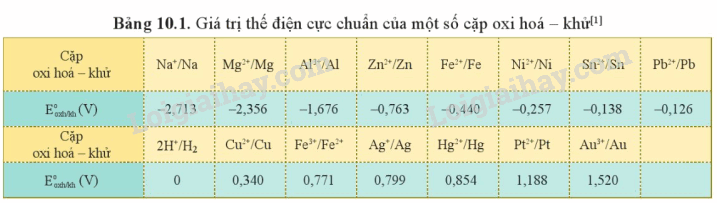
Luyện tập 3 trang 73 Hóa học 12: Hãy sắp xếp dãy các ion sau theo chiều tăng dần tính oxi hoá: Na+, Zn2+, Au3+, Ni2+, H+.
Lời giải:
So sánh: = -2,173V < = -0,763V < = -0,257V < = 0V < = 1,520V.
⟹ Sắp xếp dãy các ion theo chiều tăng dần tính oxi hóa là:
Na+ < Zn2+ < Ni2+ < H+ < Au3+
Lý thuyết Thế điện cực chuẩn của kim loại
1. Thế điện cực chuẩn
- Thế điện cực của cặp oxi hóa – khử của kim loại trong điều kiện chuẩn (nồng độ ion kim loại trong dung dịch là 1M, nhiệt độ 25oC) được gọi là thế điện cực chuẩn của kim loại, kí hiệu là
- Đơn vị thường sử dụng của thế điện cực là volt (V)
- Thế điện cực chuẩn của cặp oxi hóa – khử càng lớn thì tính khử của dạng khử càng yếu, tính oxi hóa của dạng oxi hóa càng mạnh và ngược lại.
2. Bảng thế điện cực chuẩn của kim loại và ứng dụng
Nếu càng lớn thì
+ Tính oxi hóa của Mn+ càng mạnh.
+ Tính khử của M càng yếu

Dự đoán chiều phản ứng oxi hóa – khử
Nguyên tắc chung của phản ứng oxi hóa – khử xảy ra như sau:
- Chất oxi hóa mạnh hơn + Chất khử mạnh hơn Chất khử yếu hơn + Chất oxi hóa yếu hơn
Xem thêm lời giải bài tập Hóa học lớp 12 Cánh diều hay, chi tiết khác:
Câu hỏi 1 trang 70 Hóa học 12: Cho hai phản ứng sau:...
Luyện tập 2 trang 71 Hóa học 12: Hãy viết cặp oxi hóa – khử của các kim loại trong dãy sau:...
Câu hỏi 3 trang 74 Hóa học 12: Phản ứng nào sau đây có thể xảy ra ở điều kiện chuẩn? Giải thích....
Bài 2 trang 75 Hóa học 12: Cho các cặp oxi hoá khử sau:...
Xem thêm các bài giải bài tập Hóa Học lớp 12 Cánh diều hay, chi tiết khác:
Bài 10. Thế điện cực chuẩn của kim loại