Với giải sách bài tập Hóa học 12 Bài 10: Thế điện cực chuẩn của kim loại sách Cánh diều hay, chi tiết giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập trong SBT Hóa học 12. Mời các bạn đón xem:
Sách bài tập Hóa học 12 Bài 10: Thế điện cực chuẩn của kim loại
Bài 10.1 trang 35 Sách bài tập Hóa học 12: Điền từ hoặc cụm từ thích hợp vào chỗ trống trong mỗi câu sau.
a) Dạng oxi hóa và dạng khử của cùng một …(1)… kim loại tạo nên cặp …(2)… của kim loại đó. Dạng oxi hóa là dạng …(3)… electron và dạng khử là dạng …(4)… electron.
b) Trong phản ứng: Zn(s) + Ni2+(aq) → Zn2+(aq) + Ni(s), chất oxi hóa là …(1)…, chất khử là …(2)… Cặp oxi hóa-khử của nguyên tố kim loại Ni là …(3)… và cặp oxi hóa khử của kim loại Zn là …(4)…
Lời giải:
a. (1) nguyên tố; (2) oxi hóa – khử; (3) nhận; (4) nhường.
b. (1) Ni2+; (2) Zn; (3) Ni2+/Ni; (4) Zn2+/Zn.
Bài 10.2 trang 35 Sách bài tập Hóa học 12: Những phát biểu nào sau đây về phản ứng Ce4+ + 2I- → I2 + Ce3+ là đúng?
a) Phản ứng trên đã cân bằng
b) Chất oxi hóa là Ce4+, chất khử là I-.
c) Cặp oxi hóa – khử của kim loại cerium là Ce4+/Ce, của iodine là I2/2I-
d) Phương trình hóa học của phản ứng là 2Ce4+ + 2I- → I2 + 2Ce3+.
Lời giải:
a. Sai vì tổng điện tích 2 vế chưa bằng nhau.
b. Đúng.
c. Sai vì cặp oxi hóa – khử của cerium là Ce4+/Ce3+
d. Đúng.
Bài 10.3 trang 35 Sách bài tập Hóa học 12: Điền từ hoặc cụm từ thích hợp vào chỗ trống trong mỗi câu sau:
a) Thế điện cực chuẩn của cặp oxi hóa – khử càng lớn thì tính oxi hóa của dạng oxi hóa càng …(1)… và tính khử của dạng khử càng …(2)… Ngược lại, cặp oxi hóa – khử nào có thế điện cực chuẩn càng …(3)… thì tính khử của dạng khử càng …(4)… và tính oxi hóa của dạng oxi hóa càng …(5)…
b) Thế điện cực chuẩn (Eo) của cặp oxi hóa – khử Fe2+/Fe và của cặp Cu2+/Cu lần lượt là -0,440V và 0,340V. Ion Fe2+ có tính …(1)… yếu hơn ion Cu2+ và Fe có tính …(2)… mạnh hơn Cu. Vậy ở điều kiện chuẩn, …(3)… có thể khử …(4)… về …(5)… nhưng ion Fe2+ không thể …(6)… được Cu.
Lời giải:
a. (1) mạnh; (2) yếu; (3) nhỏ; (4) mạnh; (5) yếu.
b. (1) oxi hóa; (2) khử; (3) Fe; (4) Cu2+; (5) Cu; (6) oxi hóa.
Bài 10.4 trang 35 Sách bài tập Hóa học 12: Dựa vào bảng 10.1, sách hóa học 12 bộ Cánh diều, chỉ ra những phát biểu nào sau đây là không đúng?
(a) Cu2+ có tính oxi hóa mạnh hơn Fe3+ và Cu có tính khử mạnh hơn Fe2+.
(b) Zn có tính khử mạnh hơn Pb và Zn2+ có tính oxi hóa yếu hơn Pb2+.
(c) Những kim loại có thế điện cực chuẩn âm đều khử được H+ thành H2 và phản ứng được trong dung dịch HCl.
(d) Trong dãy hoạt động hóa học, những kim loại đứng trước có thế điện cực chuẩn lớn hơn thế điện cực chuẩn của những kim loại đứng sau.
(e) Kẽm có thể khử các ion Fe2+ và Ni2+ về kim loại Fe và Ni nhưng không thể khử ion Al3+ về kim loại Al.
Lời giải:
a. Sai vì Cu2+ có tính oxi hóa yếu hơn Fe3+.
b. Đúng.
c. Đúng.
d. Sai, những kim loại đứng trước có thế điện cực nhỏ hơn.
e. Đúng.
Bài 10.5 trang 36 Sách bài tập Hóa học 12: Dự đoán những phản ứng nào sau đây có thể tự xảy ra ở điều kiện chuẩn.
(a) Zn(s) + Sn2+(aq) →
(b) Ag+(aq) + Fe(s) →
(c) Fe(s) + Mg2+(aq) →
(d) Au(s) + Cu2+(aq) →
Lời giải:
Dự đoán các phản ứng (a), (b) đây có thể tự xảy ra ở điều kiện chuẩn.
(a) Zn(s) + Sn2+(aq) → Zn2+ (aq) + Sn (s)
(b) 2Ag+(aq) + Fe(s) → Fe2+ (aq) + 2Ag (s)
Bài 10.6 trang 36 Sách bài tập Hóa học 12: Dự đoán hiện tượng nào sau đây sẽ xảy ra khi dùng một chiếc thìa bằng đồng khuấy vào cốc chứa dung dịch aluminium nitrate.
A. Chiếc thìa bị phủ một lớp nhôm.
B. Một hỗn hợp đồng và nhôm được tạo thành.
C. Dung dịch trở nên xanh.
D. Không biến đổi hóa học nào xảy ra.
Lời giải:
Đáp án đúng là: D
Do đồng hoạt động hoá học yếu hơn nhôm (aluminium) nên không có biến đổi hoá học xảy ra.
Bài 10.7 trang 36 Sách bài tập Hóa học 12: Cho các cặp oxi hóa – khử: Al3+/Al; Cr3+/Cr; Co2+/Co; Sn4+/Sn2+ và Cl2 (g)/2Cl- với các thế khử chuẩn lần lượt là -1,676 V; -0,740 V; -0,280 V; 0,150 V và 1,360 V. Trong các chất tương ứng với các cặp oxi hóa – khử trên, hãy chỉ ra:
a) Chất có tính khử mạnh nhất.
b) Chất có khả năng khử Cr3+ (aq) thành Cr (s) ở điều kiện chuẩn.
c) Chất có khả năng khử Sn4+ (aq) thành Sn2+ (aq) nhưng không khử được Cr3+ (aq) thành Cr (s) ở điều kiện chuẩn.
Lời giải:
a. Chất có tính khử mạnh nhất: Cl2(g).
b. Chất có khả năng khử Cr3+ (aq) thành Cr (s) ở điều kiện chuẩn: Al(s).
c. Chất có khả năng khử Sn4+ (aq) thành Sn2+ (aq) nhưng không khử được Cr3+ (aq) thành Cr (s) ở điều kiện chuẩn: Co (s).
Bài 10.8 trang 36 Sách bài tập Hóa học 12: Cho các thông tin sau:
X(s) + YSO4(aq) → không có phản ứng
Z(s) + YSO4 (aq) → Y(s) + ZSO4 (aq)
Trong đó, X, Y, Z là các kim loại. Dãy nào sau đây sắp xếp đúng các kim loại theo mức độ hoạt động của chúng?
A. Z > Y > X.
B. X > Y > Z.
C. Y > X > Z.
D. Y > Z > X.
Lời giải:
Đáp án đúng là: A
X(s) + YSO4(aq) → không có phản ứng nên X hoạt động hoá học yếu hơn Y.
Z(s) + YSO4 (aq) → Y(s) + ZSO4 (aq) nên Z hoạt động hoá học mạnh hơn Y.
Bài 10.9 trang 36 Sách bài tập Hóa học 12: Những phản ứng nào sau đây không tự xảy ra ở điều kiện chuẩn?
Cho
(a) Mg2+ (aq) + Pb (s) → Pb2+ (aq) + Mg (s)
(b) O2 (g) + 4H+ (aq) + 2Zn (s) → 2H2O (l) + 2Zn2+ (aq)
(c) Ni (s) + Sn2+ (aq) → Ni2+ (aq) + Sn (s)
(d) Fe (s) + Mn2+ (aq) → Fe2+ (aq) + Mn (s)
Lời giải:
Dựa vào thế điện cực chuẩn xác định được các phản ứng (a) và (d) không tự xảy ra ở điều kiện chuẩn.
Bài 10.10 trang 37 Sách bài tập Hóa học 12: Có bốn dung dịch muối không màu (AgNO3, Pb(NO3)2, Zn(NO3)2 và Ni(NO3)2) được đựng trong bốn ống nghiệm riêng biệt. Cho thêm vào 4 ống nghiệm này một sợi dây đồng. Sau một thời gian, dung dịch nào chuyển xanh? (các phản ứng đều được thực hiện ở điều kiện chuẩn).
A. AgNO3.
B. Pb(NO3)2.
C. Zn(NO3)2.
D. Ni(NO3)2.
Lời giải:
Đáp án đúng là: A
Cu + 2AgNO3 → Cu(NO3)2 (xanh) + 2Ag
Bài 10.11 trang 37 Sách bài tập Hóa học 12: Một học sinh thực hiện ba thí nghiệm ở điều kiện chuẩn và quan sát được các hiện tượng sau:
(1) Đồng kim loại không phản ứng được với dung dịch Pb(NO3)2 1M.
(2) Chì kim loại tan trong dung dịch AgNO3 1M và xuất hiện tinh thể Ag.
(3) Bạc kim loại không phản ứng với dung dịch Cu(NO3)2 1M.
Trật tự nào sau đây thể hiện đúng mức độ khử của 3 kim loại ?
A. Cu > Pb > Ag.
B. Pb > Cu > Ag.
C. Cu > Ag > Pb.
D. Pb > Ag > Cu.
Lời giải:
Đáp án đúng là: B
Từ (1) có Cu hoạt động hoá học yếu hơn Pb.
Từ (2) có Pb hoạt động hoá học mạnh hơn Ag.
Từ (3) có Cu hoạt động hoá học mạnh hơn Ag.
Vậy: Pb > Cu > Ag.
Bài 10.12 trang 37 Sách bài tập Hóa học 12: Những kim loại nào sau đây có thể được dùng để bảo vệ đường ống sắt khỏi bị gỉ?
(a) Cr.
(b) Ag.
(c) Cu.
(d) Mn.
(e) Zn.
Lời giải:
Các kim loại (a) Cr, (d) Mn, (e) Zn hoạt động hoá học mạnh hơn Fe nên có thể được dùng để bảo vệ đường ống sắt khỏi bị gỉ.
Bài 10.13 trang 37 Sách bài tập Hóa học 12: Những phản ứng hóa học nào sau đây xảy ra trong dung dịch:
(1) 2Al (s) + 3Cu2+ (aq) → 2Al3+ (aq) + 3Cu (s)
(2) 2Al (s) + 3Fe3+ (aq) → 2Al3+ (aq) + 3Fe (s)
(3) Pb2+ (aq) + Fe (s) → Fe2+ (aq) + Pb (s)
(4) Fe (s) + Cu2+ (aq) → Fe2+ (aq) + Cu (s)
(5) 2Al (s) + 3Pb2+ (aq) → 2Al3+ (aq) + 3Pb (s)
(6) Pb (s) + Cu2+ (aq) → Pb2+ (aq) + Cu (s).
Sắp xếp các kim loại tham gia các phản ứng trên theo thứ tự giảm dần về khả năng dễ bị oxi hóa.
Lời giải:
Sắp xếp: Al > Fe > Pb > Cu.
Giải thích:
Theo (1) có Al dễ bị oxi hoá hơn Cu.
Theo (2) có Al dễ bị oxi hoá hơn Fe.
Theo (3) có Fe dễ bị oxi hoá hơn Pb.
Theo (4) có Al dễ bị oxi hoá hơn Pb.
Theo (5) có Pb dễ bị oxi hoá hơn Cu.
Bài 10.14 trang 37 Sách bài tập Hóa học 12: Trong phòng thí nghiệm, một học sinh nhúng thanh đồng có khối lượng 12,340 g vào 255 mL dung dịch AgNO3 0,125M. Bằng quan sát, học sinh đó đã khẳng định có phản ứng xảy ra.
a) Vì sao học sinh đó lại khẳng định có phản ứng xảy ra chỉ bằng việc quan sát.
b) Viết và cân bằng phương trình hóa học của phản ứng.
c) Viết các cặp oxi hóa – khử tham gia phản ứng và chỉ rõ tác nhân oxi hóa và tác nhân khử.
d) Khi phản ứng kết thúc, hãy xác định khối lượng của thanh đồng, nếu giả thuyết toàn bộ lượng Ag giải phóng đều bám vào thanh đồng.
Lời giải:
a. Bằng quan sát: Dung dịch chuyển từ không màu sang màu xanh, học sinh có thể khẳng định có phản ứng xảy ra chỉ bằng việc quan sát.
b. Phương trình hoá học:
Cu (s) + 2AgNO3 (aq) → Cu(NO3)2 (aq) + 2Ag (s)
c. Các cặp oxi hóa – khử tham gia phản ứng: Cu2+/Cu; Ag+/Ag.
Cu là tác nhân khử và Ag+ là tác nhân oxi hóa.
d. Theo phương trình hóa học của phản ứng, lượng Cu tham gia phản ứng là:
Vậy khối lượng thanh đồng sau khi phản ứng kết thúc là:
(12,340 - 1,02) + (0,125.0,255).108 =14,7625 (g).
Bài 10.15 trang 37 Sách bài tập Hóa học 12: Trong phòng thí nghiệm, một bạn học sinh khi nhỏ từ từ dung dịch thuốc tím vào dung dịch Fe2+ trong môi trường acid đã quan sát thấy thuốc tím mất màu và dung dịch dần chuyển dần từ không màu sang màu vàng nhạt. Phản ứng được thực hiện ở điều kiện chuẩn.
a) Giải thích hiện tượng bạn học sinh quan sát được.
b) Viết các cặp oxi hóa – khử của hai nguyên tố Mn và Fe liên quan đến phản ứng trong quá trình trên và so sánh thế điện cực chuẩn của hai cặp oxi hóa – khử này.
c) Viết phương trình chuyển hóa giữa dạng oxi hóa và dạng khử của mỗi cặp oxi hóa – khử và phương trình hóa học khi phản ứng xảy ra.
Lời giải:
(a) Giải thích: Ion MnO4- có màu tím oxi hóa Fe2+ thành Fe3+ có màu vàng và nó bị khử thành ion Mn2+ (aq) không màu.
(b) Các cặp oxi hoá – khử: MnO4-/Mn2+; Fe3+/Fe2+;
Thế điện cực chuẩn của cặp Fe3+/Fe2+ nhỏ hơn thế điện cực chuẩn của cặp MnO4-/Mn2+.
(c)
Fe3+ (aq) + e → Fe2+ (aq)
MnO4- (aq) + 8H+ (aq) + 5e → Mn2+ (aq) + 4H2O (l)
5Fe2+ (aq) + MnO4- (aq) + 8H+ (aq) → Mn2+ (aq) + 5Fe3+ (aq) + 4H2O (l).
Lý thuyết Thế điện cực chuẩn của kim loại
I. Cặp oxi hóa – khử của kim loại
- Xét một quá trình có ion kim loại Mn+ đóng vai trò là chất oxi hóa và một quá trình kim loại M đóng vai trò là chất khử như sau:
Mn+ + ne M
M Mn+ + ne
- Trong trường hợp trên, chất oxi hóa (dạng oxi hóa) Mn+ và chất khử (dạng khử). M thuộc cùng một nguyên tố kim loại. Quá trình trên được viết gọn như sau:
Mn+ + ne M
Dạng oxi hóa Dạng khử
- Dạng oxi hóa và dạng khử của cùng một nguyên tố kim loại tạo nên cặp oxi hóa – khử của kim loại đó.
II. Thế điện cực chuẩn của kim loại
1. Thế điện cực chuẩn
- Thế điện cực của cặp oxi hóa – khử của kim loại trong điều kiện chuẩn (nồng độ ion kim loại trong dung dịch là 1M, nhiệt độ 25oC) được gọi là thế điện cực chuẩn của kim loại, kí hiệu là
- Đơn vị thường sử dụng của thế điện cực là volt (V)
- Thế điện cực chuẩn của cặp oxi hóa – khử càng lớn thì tính khử của dạng khử càng yếu, tính oxi hóa của dạng oxi hóa càng mạnh và ngược lại.
2. Bảng thế điện cực chuẩn của kim loại và ứng dụng
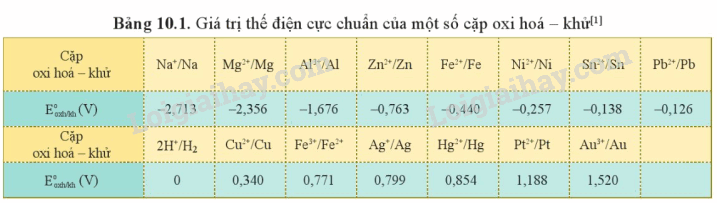
Nếu càng lớn thì
+ Tính oxi hóa của Mn+ càng mạnh.
+ Tính khử của M càng yếu

Dự đoán chiều phản ứng oxi hóa – khử
Nguyên tắc chung của phản ứng oxi hóa – khử xảy ra như sau:
- Chất oxi hóa mạnh hơn + Chất khử mạnh hơn Chất khử yếu hơn + Chất oxi hóa yếu hơn
Xem thêm các bài giải SBT Hóa học lớp 12 Cánh diều hay, chi tiết khác: