Tailieumoi.vn giới thiệu Giải bài tập Khoa học tự nhiên lớp 9 Bài 25: Acetic acid chi tiết sách Chân trời sáng tạo giúp học sinh xem và so sánh lời giải từ đó biết cách làm bài tập môn KHTN 9. Mời các bạn đón xem:
Giải bài tập KHTN 9 Bài 25: Acetic acid
Acetic có cấu tạo như thế nào? Hợp chất này có tính chất và ứng dụng gì trong đời sống?
Trả lời:
Công thức cấu tạo của acetic acid là:
- Tính chất vật lí: Acetic acid là chất lỏng, không màu, vị chua, mùi đặc trưng, sôi ở 118oC, nặng hơn nước, tan vô hạn trong nước.
- Tính chất hóa học của acetic acid:
+ Có tính chất chung của một acid: làm đổi màu quỳ tím, phản ứng với một số kim loại, oxide base, base, muối carbonate, …
+ Phản ứng với ethylic alcohol tạo ester.
- Ứng dụng: Acetic acid được dùng làm nguyên liệu trong công nghiệp thực phẩm, dược phẩm, chất dẻo, …
1. Công thức phân tử, công thức cấu tạo của acetic acid
Trả lời:
Đặc điểm công thức cấu tạo: Có một nhóm -COOH liên kết với nhóm -CH3.
2. Tính chất vật lí của acetic acid
Trả lời:
Khối lượng riêng của acetic acid là 1,045 g/mL > khối lượng riêng của nước nên acetic acid nặng hơn nước.
Khi cho acetic acid vào nước với lượng bất kì, ta luôn thu được hỗn hợp đồng nhất nên acetic acid tan vô hạn trong nước.
3. Tính chất hóa học của acetic acid
Trả lời:
Hiện tượng: Khi nhỏ dung dịch acetic acid lên mẩu giấy quỳ tím thấy quỳ tím chuyển sang màu hồng.
Giải thích: Do acetic acid có tính acid yếu.
Trả lời:
|
|
acetic acid |
ethylic alcohol |
sodium hydroxide |
|
Quỳ tím |
Màu hồng |
Không đổi màu |
Màu xanh |
Thí nghiệm 2: Acetic acid phản ứng với đá vôi (thành phần chính là CaCO3), kẽm (Zn), copper(II) oxide (CuO), sodium hydroxide (NaOH)
Dụng cụ và hoá chất: ống nghiệm, giá đỡ ống nghiệm, ống hút nhỏ giọt, cốc thuỷ tinh, dung dịch CH3COOH 1 M, đá vôi, kẽm viên, bột copper(II) oxide, dung dịch NaOH 1M, phenolphthalein.
Tiến hành thí nghiệm: Dùng ống hút nhỏ giọt lấy dung dịch acetic acid và cho từ từ lần lượt vào mỗi ống nghiệm có chứa sẵn gồm:
Ống 1: đựng đá vôi đập nhỏ (khoảng 1 gam).
Ông 2: đựng kẽm (vài viên nhỏ).
Ống 3: đựng bột copper(II) oxide (khoảng 1/3 thìa thủy tinh), sau đó đun nóng nhẹ ống nghiệm.
Ống nghiệm 4: đựng dung dịch sodium hydroxide (khoảng 3mL) có pha vài giọt phenolphthalein.
Trả lời:
Hiện tượng:
- Ống 1: đá vôi tan ra, có khí thoát ra.
2CH3COOH + CaCO3 → (CH3COO)2Ca + CO2 ↑ + H2O
- Ống 2: viên kẽm tan dần, xuất hiện bọt khí.
2CH3COOH + Zn → (CH3COO)2Zn + H2 ↑
- Ống 3: bột CuO tan dần, dung dịch chuyển sang màu xanh.
2CH3COOH + CuO → (CH3COO)2Cu + H2O
- Ống 4: màu hồng của dung dịch chuyển sang không màu.
CH3COOH + NaOH → CH3COONa + H2O
Trả lời:
Phương trình hóa học:
2CH3COOH + BaCO3 → (CH3COO)2Ba + CO2 ↑ + H2O
2CH3COOH + Mg → (CH3COO)2Mg + H2 ↑
2CH3COOH + ZnO → (CH3COO)2Zn + H2O
2CH3COOH + Ca(OH)2 → (CH3COO)2Ca + 2H2O
Câu hỏi thảo luận 5 trang 111 KHTN 9: Viết phương trình hoá học của phản ứng đốt cháy acetic acid.
Trả lời:
CH3COOH + 2O2 2CO2 + 2H2O
Thí nghiệm 3: Acetic acid phản ứng với ethylic alcohol
Dụng cụ và hoá chất: ống nghiệm, giá đỡ ống nghiệm, ống dẫn khí chữ L, cốc thuỷ tinh, acetic acid, ethylic alcohol, dung dịch sulfuric acid đặc.
Tiến hành thí nghiệm: Cho khoảng 2 mL dung dịch acetic acid và 2 mL ethylic alcohol vào ống nghiệm (A) rồi thêm tiếp vài giọt dung dịch sulfuric acid đặc làm xúc tác. Tiến hành lắp các dụng cụ thí nghiệm như Hình 25.5.
Đun nhẹ ống nghiệm (không đun sôi, khoảng 5 phút).
Trả lời:
- Tên gọi của phản ứng ở Thí nghiệm 3 là phản ứng ester hóa.
- Sản phẩm của phản ứng ester hóa là ester và nước.
4. Điều chế và ứng dụng của acetic acid
Trả lời:
Nguyên liệu: dung dịch ethylic alcohol, oxygen, men giấm
Phương trình hóa học:
C2H5OH + O2 CH3COOH + H2O
Trả lời:
Từ acetic acid có thể tạo ra một số sản phẩm như giấm ăn, chất dẻo, dược phẩm, …
Trả lời:
Một số ứng dụng khác của giấm như dùng để khử mùi tanh của cá, muối chua rau quả để lưu trữ và bảo quản lâu hơn, dùng để sát trùng nhẹ, …
Xem thêm các bài giải bài tập Khoa học tự nhiên 9 Chân trời sáng tạo hay, chi tiết khác:
Lý thuyết KHTN 9 Bài 25: Acetic acid
1. Công thức phân tử, công thức cấu tạo của acetic acid
Acetic acid có:
- Công thức phân tử: C2H4O2
- Công thức cấu tạo thu gọn CH3COOH
Đặc điểm công thức cấu tạo: có một nhóm – COOH liên kết với nhóm – CH3
2. Tính chất vật lí của acetic acid
Acetic acid là chất lỏng, không màu, vị chua, mùi đặc trưng, sôi ở 118oC, nặng hơn nước, tan vô hạn trong nước.
3. Tính chất hóa học của acetic acid
- Làm đổi màu quỳ tím
- Tính acid
Acetic acid phản ứng được với các base, oxide base, muối carbonate và nhiều kim loại tạo ra muối acetate.
Ví dụ:
CH3COOH + NaOH CH3COONa + H2O
2CH3COOH + CuO (CH3COO)2Cu + H2O
2CH3COOH + Zn (CH3COO)2Zn + H2
2CH3COOH + CaCO3 (CH3COO)2Ca + CO2 + H2O
- Tác dụng với alcohol tạo thành ester (phản ứng ester hóa)
Acetic acid phản ứng với ethylic alcohol tạo thành ester và nước theo phản ứng:
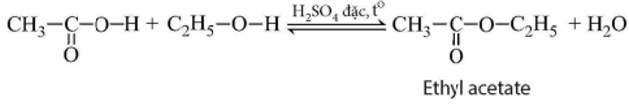
Phản ứng giữa acetic acid và ethylic alcohol tạo ra ester thuộc loại phản ứng ester hóa
- Phản ứng cháy
Acetic acid cháy trong khí oxygen tạo thành khí carbon dioxide và hơi nước:
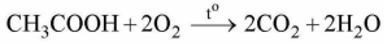
4. Điều chế và ứng dụng của acetic acid
Acetic acid có thể được điều chế từ ethylic alcohol bằng phản ứng lên men giấm
Acetic acid được dùng làm nguyên liệu trong công nghiệp thực phẩm, dược phẩm, chất dẻo,…