Tailieumoi.vn xin giới thiệu Trắc nghiệm Khoa học tự nhiên lớp 8 Bài 3: Mol và tỉ khối chất khí sách Kết nối tri thức. Bài viết gồm 20 câu hỏi trắc nghiệm với đầy đủ các mức độ và có hướng dẫn giải chi tiết sẽ giúp học sinh ôn luyện kiến thức và rèn luyện kĩ năng làm bài trắc nghiệm KHTN 8. Ngoài ra, bài viết còn có phần tóm tắt nội dung chính lý thuyết Bài 3: Mol và tỉ khối chất khí. Mời các bạn đón xem:
Trắc nghiệm KHTN 8 Bài 3: Mol và tỉ khối chất khí
Phần 1: 15 câu Trắc nghiệm KHTN 8 Bài 3: Mol và tỉ khối chất khí
Câu 1. Hai chất khí có thể tích bằng nhau (đo cùng nhiệt độ và áp suất) thì:
A. Khối lượng của 2 khí bằng nhau .
B. Số mol của 2 khí bằng nhau.
C. Số phân tử của 2 khí bằng nhau.
D. Số mol và số phân tử của 2 khí bằng nhau.
Đáp án đúng là: D
Hai chất khí có thể tích bằng nhau (đo cùng nhiệt độ và áp suất) thì: số mol và số phân tử của 2 khí bằng nhau.
Câu 2. Biết 0,02 mol chất X có khối lượng là 0,48 gam. Khối lượng mol phân tử của chất X là
A. 56.
B. 65.
C. 24.
D. 64.
Đáp án đúng là: C
Khối lượng mol phân tử của chất X là:
Câu 3. Khí NO2 nặng hơn hay nhẹ hơn không khí bao nhiêu lần?
A. Nặng hơn không khí 1,6 lần.
B. Nhẹ hơn không khí 2,1 lần.
C. Nặng hơn không khí 3 lần.
D. Nhẹ hơn không khí 4,20 lần.
Đáp án đúng là: A
Khối lượng mol phân tử khí NO2 là: 14 + 16.2 = 46 (g/mol).
Tỉ khối của khí NO2 đối với không khí:
Vậy khí NO2 nặng hơn không khí khoảng 1,6 lần.
Câu 4. Số mol tương đương với 1,5.1023 phân tử CO2 là
A. 0,20 mol.
B. 0,25 mol.
C. 0,30 mol.
D. 0,35 mol.
Đáp án đúng là: B
Câu 5. Thể tích của 2 mol khí oxygen ở điều kiện chuẩn là
A. 49,58 lít.
B. 24,79 lít.
C. 74,37 lít.
D. 99,16 lít.
Đáp án đúng là: A
V = n.24,79 = 2.24,79 = 49,58 lít.
Câu 6. Khối lượng nguyên tử carbon là
A. 16 amu.
B. 12 amu.
C. 24 amu.
D. 6 amu.
Đáp án đúng là: B
Khối lượng nguyên tử carbon là 12 amu.
Câu 7. Thể tích mol của các chất khí bất kì bằng nhau nếu được đo ở
A. cùng nhiệt độ.
B. cùng áp suất.
C. cùng nhiệt độ và khác áp suất .
D. cùng điều kiện nhiệt độ và áp suất.
Đáp án đúng là: D
Thể tích mol của các chất khí bất kì bằng nhau nếu được đo ở cùng điều kiện nhiệt độ và áp suất.
Câu 8. Ở điều kiện chuẩn (25 oC và 1 bar) thì 1 mol của bất kì chất khí nào đều chiếm thể tích là
A. 2,479 lít.
B. 24,79 lít.
C. 22,79 lít.
D. 22,40 lít.
Đáp án đúng là: B
Ở điều kiện chuẩn (25 oC và 1 bar) thì 1 mol của bất kì chất khí nào đều chiếm thể tích là 24,79 lít.
Câu 9. Tỉ lệ giữa khối lượng mol của khí A (MA) và khối lượng mol của khí B (MB) được gọi là
A. khối lượng mol.
B. thể tích mol.
C. mol.
D. tỉ khối của khí A đối với khí B.
Đáp án đúng là: D
Tỉ khối của khí A đối với khí B là tỉ lệ khối lượng mol giữa khí A và khí B.
Câu 10. Công thức đúng về tỉ khối của chất khí A đối với không khí là
A. dA/kk = MA .29
C.
D. Cả A, B, C đều sai.
Đáp án đúng là: B
Tỉ khối của chất khí A đối với không khí: .
Câu 11. Số phân tử Al2O3 có trong 1 mol Al2O3 là
A. 6,022.1023.
B. 18,066.1023.
C. 12,044.1023.
D. 24,088.1023.
Đáp án đúng là: A
Mol là lượng chất có chứa 6,022.1023 nguyên tử hoặc phân tử chất đó.
Câu 12. Lượng chất nào sau đây chứa số mol nhiều nhất?
A. 16 gam O2.
B. 8 gam SO2.
C. 16 gam CuSO4.
D. 32 gam Fe2O3.
Đáp án đúng là: A
|
Chất |
O2 |
SO2 |
CuSO4 |
Fe2O3 |
|
Khối lượng |
16 |
8 |
16 |
32 |
|
Số mol tính được |
0,5 |
0,125 |
0,1 |
0,2 |
Câu 13. Số nguyên tử iron có trong 28 gam iron là
A. 2,10.1023.
B. 2,51.1023.
C. 3,01.1023.
D. 3,51.1023.
Đáp án đúng là: C
Số mol nguyên tử iron trong 28 gam là:
Ta có trong 1 mol nguyên tử có 6,022.1023 nguyên tử;
Vậy số nguyên tử iron là: 0,5.6,022.1023 = 3,011.1023 nguyên tử.
Câu 14. Dãy các chất khí đều nặng hơn không khí là
A. SO2, Cl2, H2S.
B. N2, CO2, H2.
C. CH4, H2S, O2.
D. Cl2, SO2, N2.
Đáp án đúng là: A
Dãy các chất khí đều nặng hơn không khí là: SO2 (M = 64), Cl2 (M = 71), H2S (M = 34).
Câu 15. Thể tích của 0,35 mol khí CO2 ở điều kiện chuẩn là
A. 0,868 lít.
B. 8,68 lít.
C. 86,8 lít.
D. 868 lít.
Đáp án đúng là: B
Thể tích 0,35 mol CO2 ở đkc là: 0,35 × 24,79 = 8,68 (lít).
Phần 2: Lý thuyết KHTN 8 Bài 3: Mol và tỉ khối chất khí
I. Mol
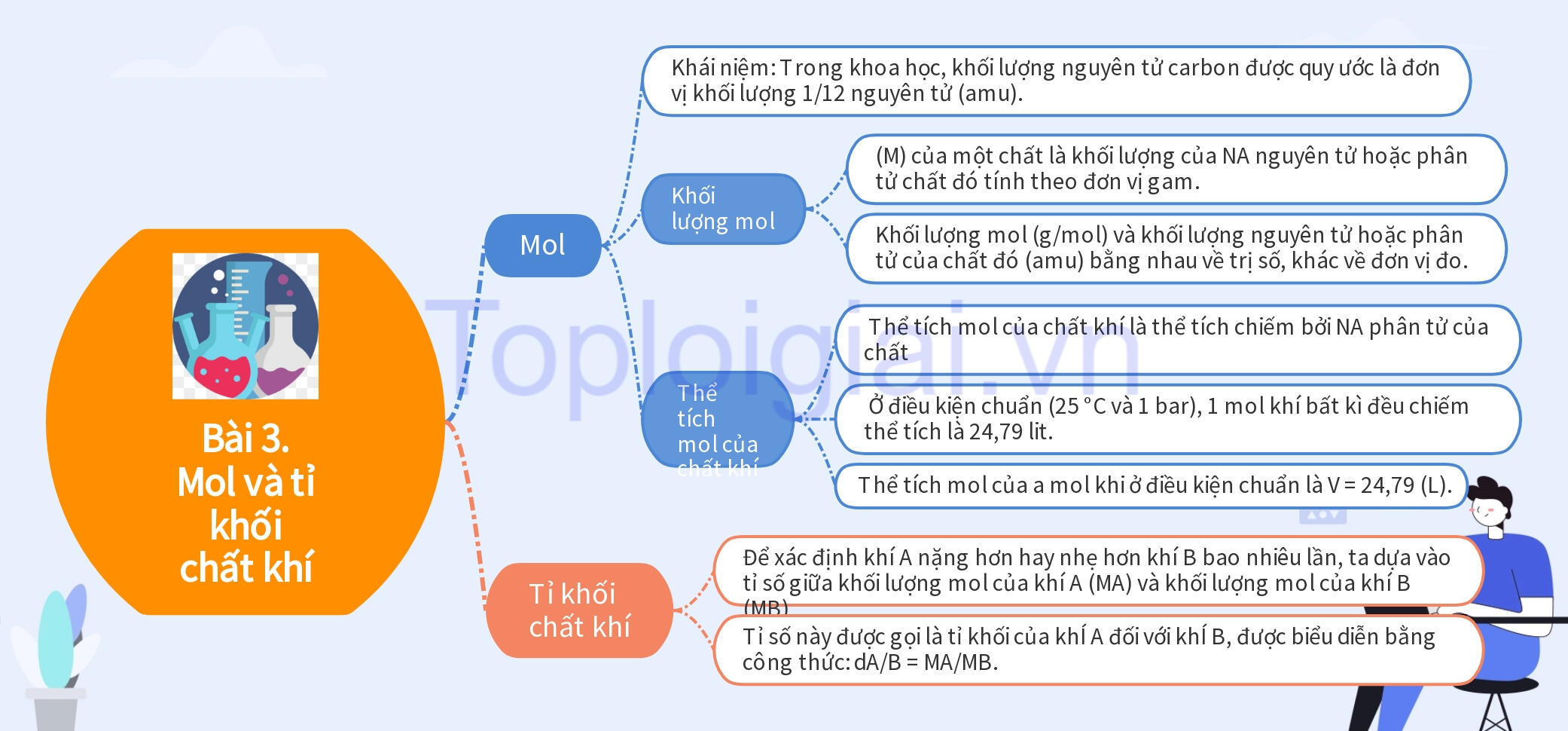
- Khái niệm: Trong khoa học, khối lượng nguyên tử carbon được quy ước là đơn vị khối lượng 1/12 nguyên tử (amu).
- Khối lượng 1 nguyên tử carbon là 12 amu và khối lượng này rất nhỏ.
- Số Avogadro (Ng) là số nguyên tử trong 12 gam carbon và có giá trị là 6,022x10²³.

- (M) của một chất là khối lượng của NA nguyên tử hoặc phân tử chất đó tính theo đơn vị gam.
- Khối lượng mol (g/mol) và khối lượng nguyên tử hoặc phân tử của chất đó (amu) bằng nhau về trị số, khác về đơn vị đo.
- Thể tích mol của chất khí là thể tích chiếm bởi NA phân tử của chất khi đó và ở cùng điều kiện nhiệt độ và áp suất, hai bình khí có thể tích bằng nhau có cùng số mol khí.
- Ở điều kiện chuẩn (25 °C và 1 bar), 1 mol khí bất kì đều chiếm thể tích là 24,79 lit.
- Thể tích mol của a mol khi ở điều kiện chuẩn là V = 24,79 (L).
- Để xác định khí A nặng hơn hay nhẹ hơn khí B bao nhiêu lần, ta dựa vào tỉ số giữa khối lượng mol của khí A (MA) và khối lượng mol của khí B (MB). Tỉ số này được gọi là tỉ khối của khÍ A đối với khÍ B, được biểu diễn bằng công thức: dA/B = MA/MB.
- Để xác định một khi A nặng hơn hay nhẹ hơn không khí bao nhiêu lần, ta dựa vào tỉ số giữa khối lượng mol của khí A và "khối lượng mol" của không khí:
- Coi không khí gồm 20% oxygen và 80% nitrogen về thể tích. Vậy trong 1 mol không khí có 0,2 mol oxygen và 0,8 mol nitrogen. Khối lượng mol của không khí là: Mkk= 0,2×32 + 0,8×28 = 28.8 (g/mol).
Tỉ khối của khí A so với không khí là: d = m/Mkk.
Sơ đồ tư duy KHTN 8 Bài 3: Mol và tỉ khối chất khí
Xem thêm các bài Trắc nghiệm Khoa học tự nhiên 8 Kết nối tri thức hay, chi tiết khác:
Trắc nghiệm Bài 2: Phản ứng hóa học
Trắc nghiệm Bài 3: Mol và tỉ khối chất khí
Trắc nghiệm Bài 4: Dung dịch và nồng độ
Trắc nghiệm Bài 5: Định luật bảo toàn khối lượng và phương trình hóa học
Trắc nghiệm Bài 6: Tính theo phương trình hóa học
Trắc nghiệm Bài 7: Tốc độ phản ứng và chất xúc tác