Với tóm tắt lý thuyết Khoa học tự nhiên lớp 7 Bài 5: Giới thiệu về liên kết hóa học sách Cánh diều hay, chi tiết cùng với bài tập trắc nghiệm chọn lọc có đáp án giúp học sinh nắm vững kiến thức trọng tâm, ôn luyện để học tốt môn KHTN 7.
Khoa học tự nhiên lớp 7 Bài 5: Giới thiệu về liên kết hóa học
Video giải KHNT 7 Bài 5: Giới thiệu về liên kết hóa học - Cánh diều
A. Lý thuyết KHTN 7 Bài 5: Giới thiệu về liên kết hóa học
I. Đặc điểm cấu tạo vỏ nguyên tử khí hiếm
- Lớp vỏ ngoài cùng của các nguyên tử khí hiếm có 8 electron (riêng He có 2 electron) là lớp vỏ bền vững. Vì vậy các nguyên tử khí hiếm tồn tại độc lập trong điều kiện thường.
- Một số mô hình cấu tạo vỏ nguyên tử của khí hiếm:
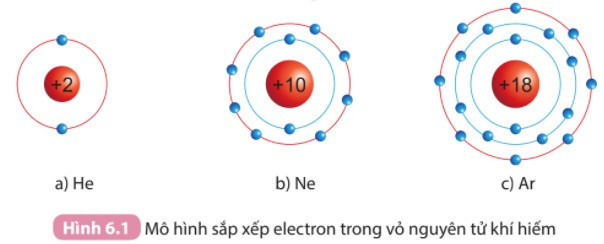
- Nguyên tử của nguyên tố khác có lớp vỏ ngoài cùng kém bền, có xu hướng tạo thành lớp vỏ tương tự khí hiếm khi liên kết với các nguyên tử khác.
II. Liên kết ion
1. Sự tạo thành liên kết ion
- Liên kết ion là liên kết được tạo thành bởi lực hút giữa ion dương và ion âm. Chất được tạo thành các ion dương và ion âm được gọi là hợp chất ion.
- Khi kim loại điển hình kết hợp với phi kim điển hình, nguyên tử kim loại sẽ cho electron tạo thành ion dương, nguyên tử phi kim sẽ nhận electron tạo thành ion âm. Các ion âm và ion dương hút nhau, tạo ra hợp chất ion.
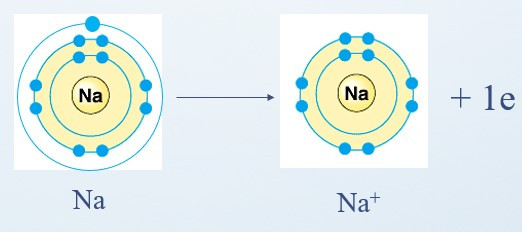
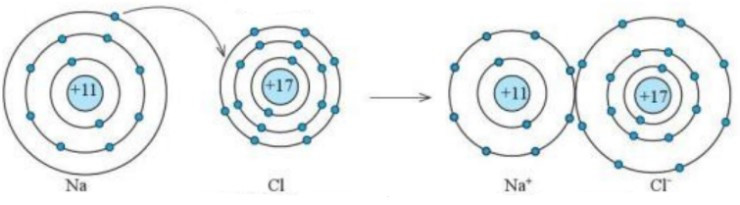
Ví dụ 1: Sự tạo thành liên kết trong phân tử sodium chloride:
+ Nguyên tử Na cho đi 1 electron ở lớp ngoài cùng trở thành ion mang điện tích dương, kí hiệu là Na+:
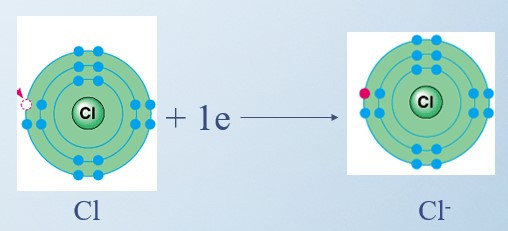
+ Nguyên tử Cl nhận 1 electron ở lớp ngoài cùng trở thành ion mang điện tích âm, kí hiệu là Cl-
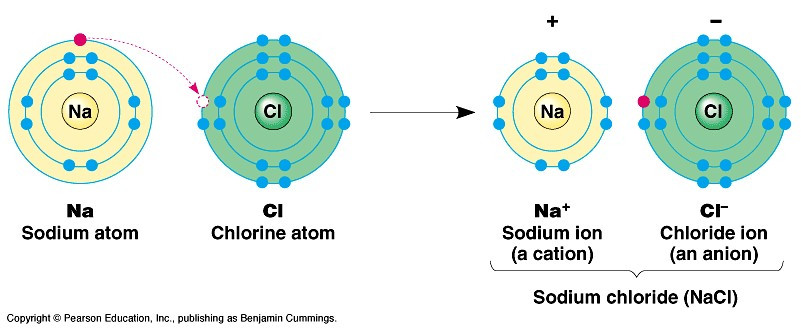
+ Các ion Na+ và Cl- hút nhau tạo thành liên kết trong phân tử sodium chloride:
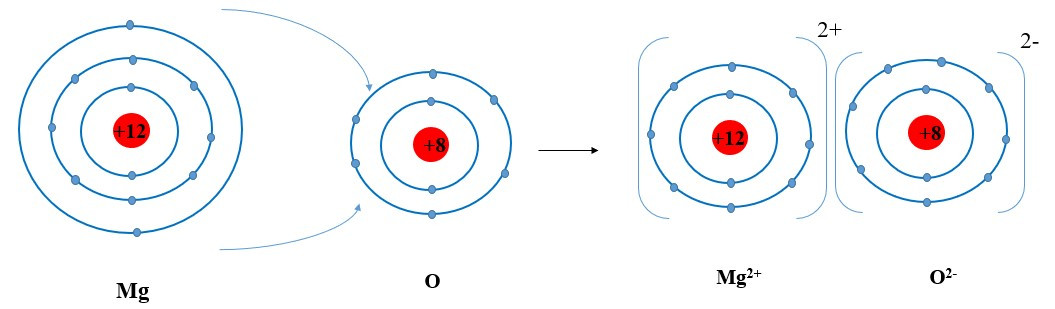
Ví dụ 2: Sự tạo thành liên kết trong phân tử magnesium oxide
+ Nguyên tử Mg cho đi 2 electron ở lớp ngoài cùng trở thành ion mang hai điện tích dương, kí hiệu Mg2+:
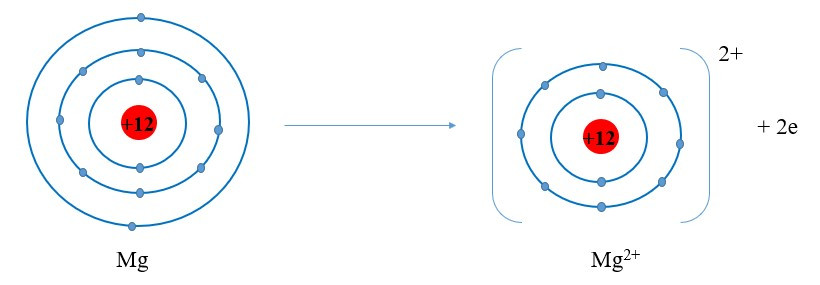
+ Nguyên tử O nhận 2 electron ở lớp ngoài cùng trở thành ion mang hai điện tích âm, kí hiệu là O2-:
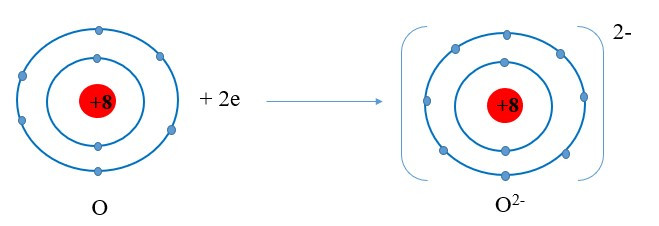
+ Các ion Mg2+ và O2- hút nhau tạo thành liên kết trong phân tử magnesium oxide:
2. Tính chất chung của hợp chất ion
+ Là chất rắn ở điều kiện thường.
Ví dụ: potassium chloride, copper oxide,…
+ Thường có nhiệt độ nóng chảy và nhiệt độ sôi cao.
Ví dụ: aluminium oxide, sodium chloride, copper oxide,…
+ Khi tan trong nước tạo ra dung dịch dẫn điện.
Ví dụ: sodium chloride, magnesium chloride,…

III. Liên kết cộng hóa trị
1. Sự tạo thành liên kết cộng hóa trị
- Liên kết cộng hóa trị là liên kết được tạo thành bởi một hoặc nhiều đôi electron dùng chung giữa hai nguyên tử.
- Chất được tạo thành nhờ liên kết cộng hóa trị giữa các nguyên tử được gọi là chất cộng hóa trị.
- Để có lớp vỏ electron bền vững tương tự khí hiếm, các nguyên tử phi kim sẽ góp các electron để tạo ra một hoặc nhiều đôi electron dùng chung giữa các nguyên tử và liên kết với nhau thành phân tử.
Ví dụ 1: Sự tạo thành liên kết trong phân tử hydrogen
+ Nguyên tử H chỉ có 1 electron và cần thêm 1 electron để có lớp vỏ bền vững tương tự khí hiếm.
+ Khi hai nguyên tử H liên kết với nhau, mỗi nguyên tử góp 1 electron để tạo ra đôi electron dùng chung.
+ Hạt nhân của hai nguyên tử H cùng hút đôi electron dùng chung và liên kết với nhau tạo thanh phân tử hydrogen. Liên kết như này được gọi là liên kết cộng hóa trị.
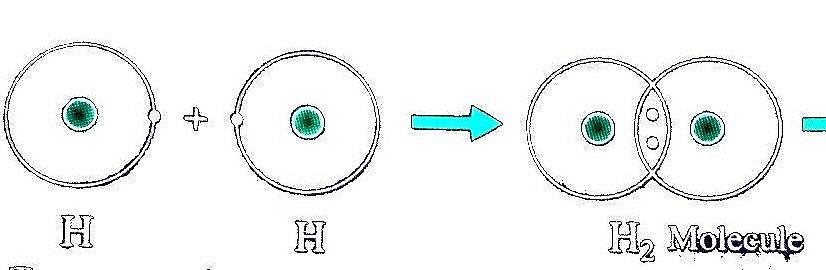
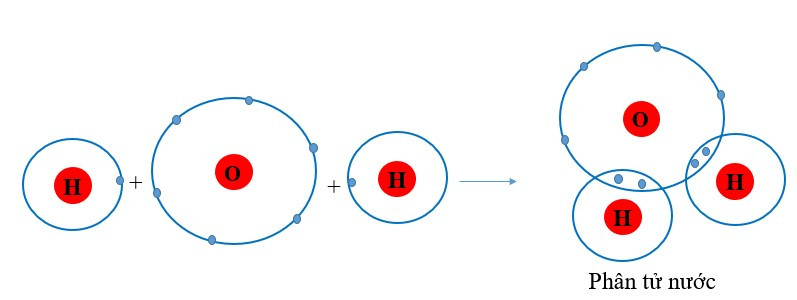
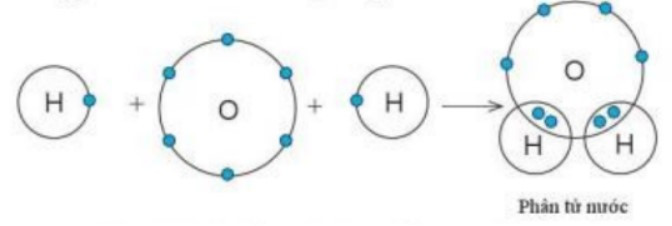
Ví dụ 2: Sự tạo thành liên kết trong phân tử nước
+ Khi O kết hợp với H, nguyên tử O góp 2 electron, mỗi nguyên tử H góp 1 electron. Giữa nguyên tử O và nguyên tử H có 1 electron dùng chung.
+ Hạt nhân nguyên tử O và H cùng hút đôi electron dùng chung, liên kết với nhau tạo ra phân tử nước.
2. Một số đặc điểm của chất cộng hóa trị
+ Có cả ba thể: thế rắn (đường ăn, iodine,…), thể lỏng (bromine, ethanol,…), thể khí (oxygen, nitrogen, khí carbonic,…).
+ Các chất cộng hóa trị thường có nhiệt độ sôi và nhiệt độ nóng chảy thấp.
+ Nhiều chất cộng hóa trị không dẫn điện (đường ăn, ethanol,…).
B. Bài tập trắc nghiệm KHTN 7 Bài 5: Giới thiệu về liên kết hóa học
Câu 1. Liên kết cộng hóa trị là
A. liên kết được tạo thành bởi lực hút giữa ion dương và ion âm;
B. liên kết được tạo thành bởi một hoặc nhiều đôi electron dùng chung giữa hai nguyên tử;
C. liên kết được tạo thành bởi một hoặc nhiều đôi electron riêng giữa hai nguyên tử;
D. Cả B và C.
Đáp án: B
Giải thích:
Liên kết cộng hóa trị là liên kết được tạo thành bởi một hoặc nhiều đôi electron dùng chung giữa hai nguyên tử.
Câu 2. Chất nào sau đây không là chất cộng hóa trị
A. khí carbonic;
B. nước;
C. khí hydrogen;
D. magnesium oxide.
Đáp án: D
Giải thích:
Chất cộng hóa trị là chất được tạo thành nhờ liên kết cộng hóa trị giữa các nguyên tử.
Do đó, khí carbonic, nước, khí hydrogen là chất cộng hóa trị.
Magnesium oxide không là chất cộng hóa trị.
Câu 3. Nhận định nào sau đây sai khi nói về sự hình thành liên kết trong phân tử nước?
A. Nguyên tử O góp 2 electron;
B. Nguyên tử H góp 2 electron;
C. Giữa nguyên tử O và nguyên tử H có một đôi electron chung;
D. Hạt nhân của nguyên tử O và H cùng hút đôi electron dùng chung, liên kết với nhau tạo thành phân tử nước.
Đáp án: B
Giải thích:
Nhân định B sai vì mỗi nguyên tử H chỉ góp 1 electron.
Câu 4. Tính chất nào sau đây không là tính chất chung của hợp chất ion?
A. Là chất rắn ở điều kiện thường;
B. Thường có nhiệt độ nóng chảy và nhiệt độ sôi thấp;
C. Khi tan trong nước tạo thành dung dịch dẫn được điện;
D. Đáp án khác.
Đáp án: B
Giải thích:
Tính chất không là tính chất chung của hợp chất ion là: Thường có nhiệt độ nóng chảy và nhiệt độ sôi thấp.
Vì các hợp chất ion thường có nhiệt độ nóng chảy và nhiệt độ sôi cao.
Câu 5. Cho các nhận định sau
1) Các chất cộng hóa trị là chất khí ở điều kiện thường.
2) Thường có nhiệt độ sôi, nhiệt độ nóng chảy thấp.
3) Chất cộng hóa trị đều dẫn điện.
Nhận định đúng là
A. 1, 2;
B. 2;
C. 2, 3;
D. 1, 3.
Đáp án: B
Giải thích:
1) Các chất cộng hóa trị là chất khí ở điều kiện thường. Sai vì tồn tại ở cả 3 thể (rắn, lỏng, khí)
2) Thường có nhiệt độ sôi, nhiệt độ nóng chảy thấp. Đúng.
3) Chất cộng hóa trị đều dẫn điện. Sai vì nhiều chất cộng hóa trị không dẫn điện.
Câu 6. Số electron lớp vỏ ngoài cùng của các nguyên tử khí hiếm là
A. 1 electron;
B. 2 electron;
C. 8 electron (riêng He có 2 electron);
D. 6 electron (riêng He có 2 electron).
Đáp án: C
Giải thích:
Số electron ở lớp vỏ ngoài cùng của các nguyên tử khí hiếm là 8 electron (riêng He có 2 electron). Đây là lớp vỏ bền vững.
Câu 7. Nguyên tử nào sau đây tồn tại độc lập ở điều kiện thường
A. nguyên tử phi kim;
B. nguyên tử kim loại;
C. nguyên tử oxygen;
D. nguyên tử khí hiếm.
Đáp án: D
Giải thích:
Nguyên tử tồn tại độc lập ở điều kiện thường là nguyên tử khí hiếm do có lớp vỏ electron bền vững.
Câu 8. Sự hình thành liên kết trong phân tử sodium chloride diễn ra như sau
A. Nguyên tử Na cho đi 1 electron ở lớp ngoài cùng để trở thành ion mang điện tích dương (Na+), nguyên tử Cl nhận 1 electron từ nguyên tử Na để trở thành ion mang điện tích âm (Cl−), các ion Na+ và Cl− hút nhau tạo thành liên kết trong phân tử sodium chloride;
B. Nguyên tử Cl cho đi 1 electron ở lớp ngoài cùng để trở thành ion mang điện tích dương (Cl+), nguyên tử Na nhận 1 electron từ nguyên tử Cl để trở thành ion mang điện tích âm (Na−), các ion Cl+ và Na− hút nhau tạo thành liên kết trong phân tử sodium chloride;
C. Nguyên tử Cl cho đi 1 electron ở lớp ngoài cùng để trở thành ion mang điện tích dương (Cl−), nguyên tử Na nhận 1 electron từ nguyên tử Cl để trở thành ion mang điện tích âm (Na+), các ion Cl− và Na+ hút nhau tạo thành liên kết trong phân tử sodium chloride;
D. Nguyên tử Na cho đi 1 electron ở lớp ngoài cùng để trở thành ion mang điện tích âm (Na−), nguyên tử Cl nhận 1 electron từ nguyên tử Na để trở thành ion mang điện tích dương (Cl+), các ion Na− và Cl+ hút nhau tạo thành liên kết trong phân tử sodium chloride.
Đáp án: A
Giải thích:
Sự hình thành liên kết trong phân tử sodium chloride diễn ra như sau
Nguyên tử Na cho đi 1 electron ở lớp ngoài cùng để trở thành ion mang điện tích dương (Na+), nguyên tử Cl nhận 1 electron từ nguyên tử Na để trở thành ion mang điện tích âm (Cl−), các ion Na+ và Cl− hút nhau tạo thành liên kết trong phân tử sodium chloride.
Câu 9. Liên kết được tạo thành bởi lực hút giữa ion dương và ion âm là
A. liên kết cộng hóa trị;
B. liên kết ion;
C. liên kết hydrogen;
D. liên kết đơn.
Đáp án: B
Giải thích:
Liên kết được tạo thành bởi lực hút giữa ion dương và ion âm là liên kết ion.
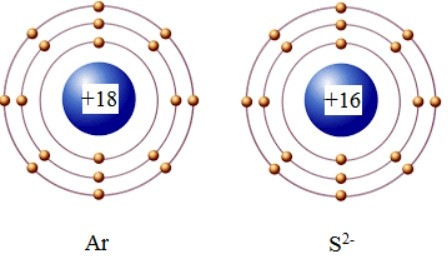
Câu 10. Ion S2− có lớp vỏ electron tương tự nguyên tử nguyên tố khí hiếm nào?
A. Helium;
B. Argon;
C. Neon;
D. Krypton.
Đáp án: B
Giải thích:
Nguyên tử S (Z = 16) có 2 elctron ở lớp thứ nhất; 8 electron ở lớp thứ 2, và còn lại 6 electron ở lớp thứ 3.
Ion S2− được hình thành khi nguyên tử S nhận thêm 2 electron vào lớp thứ 3, tức là có 8 electron ở lớp thứ 3.
Khi đó ion S2− có lớp vỏ electron tương tự nguyên tử nguyên tố khí hiếm argon (Ar).
Xem thêm các bài tóm tắt lý thuyết Khoa học tự nhiên 7 Cánh diều hay, chi tiết khác:
Bài 4: Phân tử, đơn chất, hợp chất
Bài 6: Hóa trị, công thức hóa học
Bài 8: Đồ thị quãng đường – thời gian