Tailieumoi.vn xin giới thiệu bộ đề thi giữa kì 1 môn Khoa học tự nhiên 8 sách Cánh diều năm 2024 – 2025. Tài liệu gồm 4 đề thi có ma trận chuẩn bám sát chương trình học và đáp án chi tiết, được biên soạn bởi đội ngũ giáo viên THCS dày dặn kinh nghiệm sẽ giúp các em ôn tập kiến thức và rèn luyện kĩ năng nhằm đạt điểm cao trong bài thi Giữa học kì 1 KHTN 8. Mời các bạn cùng đón xem:
Chỉ từ 80k mua trọn bộ Đề thi giữa học kì 1 Khoa học tự nhiên 8 Chân trời sáng tạo word có lời giải chi tiết (chỉ từ 20k cho 1 đề thi lẻ bất kì):
B1: Gửi phí vào tài khoản 0711000255837 - NGUYEN THANH TUYEN - Ngân hàng Vietcombank (QR)
B2: Nhắn tin tới zalo Vietjack Official - nhấn vào đây để thông báo và nhận tài liệu.
Xem thử tài liệu tại đây: Link tài liệu
Đề thi giữa kì 1 Khoa học tự nhiên 8 Cánh diều có đáp án năm 2024
Đề thi giữa kì 1 Khoa học tự nhiên 8 Cánh diều có đáp án - Đề 1
Phòng Giáo dục và Đào tạo ...
Đề thi Giữa kì 1 - Cánh diều
Năm học 2024 – 2025
Môn: Khoa học tự nhiên 8
Thời gian làm bài: phút
(Đề số 1)
Câu 1: Công dụng của thìa thủy tinh là
A. đo khối lượng.
B. lấy hóa chất rắn.
C. cố định ống nghiệm.
D. đun nóng.
Câu 2: Trong các quá trình sau, quá trình nào xảy ra biến đổi hóa học?
A. Muối ăn hòa vào nước thành nước muối.
B. Bật bếp ga thấy lửa màu xanh.
C. Cồn bay hơi khi mở nắp.
D. Mở lọ nước hoa thấy mùi thơm.
Câu 3: Chất phản ứng của phản ứng: nhôm (aluminium) + chlorine → aluminium chloride là
A. nhôm (aluminium).
B. aluminium chloride.
C. chlorine.
D. nhôm (aluminium) và chlorine.
Câu 4: Phản ứng tỏa nhiệt là phản ứng trong đó
A. hỗn hợp phản ứng truyền nhiệt cho môi trường.
B. chất phản ứng truyền nhiệt cho sản phẩm.
C. chất phản ứng thu nhiệt từ môi trường
D. các chất sản phẩm thu nhiệt từ môi trường.
Câu 5: Khối lượng của 0,2 mol Al2O3 là
A. 10,2g B. 2,04g
C. 1,02g D. 20,4g
Câu 6: Đốt cháy hoàn toàn 0,384 gam magnesium trong khí oxygen, thu được 0,640 gam magnesium oxide. Có bao nhiêu gam oxygen đã tham gia phản ứng
A. 0,640 gam
B. 0,256 gam
C. 0,320 gam
D. 0,512 gam
Câu 7: ở 25oC, 250 gam nước có thể hòa tan tối đa 80 gam KNO3, độ tan của KNO3 ở 25oC là
A. 32 gam/ 100 gam H2O
B. 36 gam/ 100 gam H2O
C. 80 gam/ 100 gam H2O
D. 40 gam/ 100 gam H2O
Câu 8: Trong phòng thí nghiệm, khí O2 được điều chế từ phản ứng tỏa nhiệt phân potassium permanganate (KMnO4): 2 KMnO4 ® K2MnO4 + MnO2 + O2 .Đem nhiệt phân hoàn toàn 7, 9 gam potassium permanganate thu được khối lượng khí O2 là
A. 0,2 gam.
B. 1,6 gam
C. 0,4 gam.
D. 0,8 gam.
Câu 9: Khi đốt củi, để tăng tốc độ cháy, người ta sử dụng biện pháp nào sau đây?
A. Đốt trong lò kín.
B. Xếp củi chặt khít.
C. Thổi không khí khô.
D. Thổi hơi nước.
Câu 10: Chất nào sau đây không phản ứng với sắt?
A. NaCl. B. CH3COOH.
C. H2SO4. D. HCl.
Câu 11: Dãy chất nào sau đây chỉ gồm các base không tan?
A. Fe(OH)2, Mg(OH)2, NaOH.
B. Fe(OH)3, Cu(OH)2, KOH.
C. Mg(OH)2, Cu(OH)2, Ba(OH)2.
D. Fe(OH)3, Mg(OH)2, Cu(OH)2.
Câu 12: Chất nào sau đây là oxide lưỡng tính?
A. Fe2O3.
B. CaO.
C. SO3.
D. Al2O3.
Câu 13: Cho sơ đồ phản ứng sau:
? + 2HCl → ZnCl2 + H2
Chất thích hợp để điền vào vị trí dấu hỏi là
A. Zn(OH)2. B. ZnO.
C. Zn. D. ZnCO3.
Câu 14: Dung dịch không màu X có pH = 10, dung dịch không màu Y có pH=4. Khi nhỏ dung dịch phenolphtalein vào các dung dịch X và Y thì có hiện tượng:
A. Dung dịch X và Y chuyển sang màu hồng.
B. Dung dịch X và Y không chuyển màu.
C. Dung dịch X chuyển màu hồng, dung dịch Y không chuyển màu.
D. Dung dịch X không đổi màu, dung dịch Y chuyển sang màu hồng.
Câu 15: Công thức hóa học của một trong các loại phân bón kép là
A. K2SO4
B. (NH4)2SO4
C.KNO3
D. Ca3(PO4)2.
II. Tự luận
Câu 1: Hoàn thành sơ đồ phản ứng sau
![]()
Câu 2: Một nguyên tố R có hoá trị II. Trong thành phần oxide của R, oxygen chiếm 40% về khối lượng.
a) Tìm công thức oxide đó?
b) Cho 4g oxide trên tác dụng vừa đủ với 200ml dung dịch HCl, tính nồng độ dung dịch HCl đã dùng.
ĐÁP ÁN
Phần trắc nghiệm
|
1B |
2B |
3D |
4A |
5D |
6B |
7B |
8D |
|
9C |
10A |
11D |
12D |
13C |
14C |
15C |
|
Câu 5:
m Al2O3 = 0,2 . 102 = 20,4g
Đáp án D
Câu 6:
m magnesium + m oxygen = m magnesium dioxide
=> m oxygen = 0,640 – 0,384 = 0,256g
Đáp án B
Câu 7:
Đáp án A
Câu 8:
Theo phương trình: n KMnO4 = 2 n O2 => n O2 = 0,05 : 2 = 0,025 mol
=> m O2 = 0,025.32 = 0,8g
Đáp án D
II. Tự luận
Câu 1: Hoàn thành sơ đồ phản ứng sau
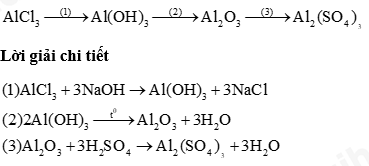
Câu 2: Một nguyên tố R có hoá trị II. Trong thành phần oxide của R, oxygen chiếm 40% về khối lượng.
a) Tìm công thức oxide đó?
b) Cho 4g oxide trên tác dụng vừa đủ với 200ml dung dịch HCl, tính nồng độ dung dịch HCl đã dùng.
Lời giải:
a) Carbon dioxide: CO2.
R hoá trị II nên oxide có công thức RO.
Tỉ lệ oxygen: ⇒ R = 24.
Vậy R là Mg, oxide là MgO.
b, n MgO = 4 : 40 = 0,1 mol
Đề thi giữa kì 1 Khoa học tự nhiên 8 Cánh diều có đáp án - Đề 2
Phòng Giáo dục và Đào tạo ...
Đề thi Giữa kì 1 - Cánh diều
Năm học 2024 – 2025
Môn: Khoa học tự nhiên 8
Thời gian làm bài: phút
(Đề số 2)
I. Trắc nghiệm ( 7,5 điểm)
Câu 1: Công dụng của bình thủy tinh có nút nhám là
A. đo khối lượng.
B. đo thể tích.
C. bảo quản hóa chất.
D. đun nóng.
Câu 2: Trong các quá trình sau, quá trình nào xảy ra biến đổi vật lí?
A. Đường cháy thành than.
B. Cơm để lâu bị ôi thiu.
C. Sữa chua lên men.
D. Nước hóa rắn ở 0oC.
Câu 3: Sản phẩm của phản ứng: Sắt (iron) + hydrochloric acid → iron (II) chloride + hydrogen là
A. sắt (iron).
B. hydrochloric acid.
C. iron (II) chloride.
D. iron (II) chloride và hydrogen.
Câu 4: Những loại phản ứng nào sau đây cần phải cung cấp năng lượng trong quá trình phản ứng?
A. Phản ứng đốt cháy cồn.
B. Phản ứng quang hợp.
C. Phản ứng đốt cháy xăng.
D. Phản ứng đốt cháy que diêm
Câu 5: Số mol của 50g CaCO3 là:
A. 2 B. 1
C. 0,5 D. 1,5
Câu 6: Biết phần trăm khối lượng đường trong 120g cốc nước đường là 1,8%. Khối lượng đường trong cốc nước đường là:
A. 1,8g B. 2,16g
C. 12g D. 18g
Câu 7: Khối lượng của CuSO4 có trong 100ml dung dịch CuSO4 0,5 M là
A. 80 gam
B. 160 gam
C. 16 gam.
D. 8 gam.
Câu 8: Cho 4,8 gam Mg tác dụng với dung dịch chứa 3,65 gam hydrochloride acid(HCl) thu được magnesium chloride (MgCl2) và khí hydrogen. Thể tích khí H2 thu được ở dktc là
A. 2,2400 lít.
B. 2,4790 lít.
C. 1,2395 lít.
D. 4,5980 lít.
Câu 9: Những phát biểu nào dưới đây là đúng?
(a) Khi đốt củi, nếu thêm một ít dầu hỏa, lửa sẽ cháy mạnh hơn. Như vậy, dầu hỏa là chất xúc tác cho quá trình này.
(b) Trong quá trình sản xuất rượu (ethylic alcohol) từ gạo, người rắc men gạo đã nấu chín (cơm) trước khi ủ vì men là chất xúc tác có tác dụng làm tăng tốc độ phản ứng chuyển hóa tinh bột thành rượu.
(c) Một chất xúc tác có thể là chất xúc tác cho tất cả phản ứng.
(d) Có thể dùng chất ức chế để làm giảm tốc độ của phản ứng.
A. 1 B. 2
C. 3 D. 4
Câu 10: Dãy dung dịch/chất lỏng nào sau đây làm đổi màu quỳ tím thành đỏ?
A. HNO3, H2O, H3PO4.
B. CH3COOH, HCl, HNO3.
C. HBr, H2SO4, H2O.
D. HCl, NaCl, KCl.
Câu 11: Dãy chất nào sau đây chỉ gồm các base tan?
A. Ba(OH)2, NaOH, KOH.
B. NaOH, Mg(OH)2, KOH.
C. NaOH, KOH, Cu(OH)2.
D. Mg(OH)2, Cu(OH)2, KOH.
Câu 12: Chất nào sau đây tác dụng được với dung dịch NaOH?
A. Na2O. B. CaO.
C. SO2. D. Fe2O3.
Câu 13: Phản ứng nào sau đây không tạo ra muối?
A. Acid tác dụng với base.
B. Kim loại tác dụng với oxygen.
C. Acid tác dụng với oxide base.
D. Base tác dụng với oxide acid.
Câu 14: Dung dịch X có pH = 3,0; dung dịch Y có pH = 9,0. Kết luận nào sau đây về dung dịch X và Y là đúng?
A. Cả X và Y đều là dung dịch acid.
B. Cả X và Y đều là dung dịch base.
C. X là dung dịch acis, Y là dung dịch base.
D. X là dung dịch base, Y là dung dịch acid
Câu 15: Công thức hóa học của một trong các loại phân đạm là
A. KCl.
B. NaCl.
C. MgSO4.
D. NH4NO3
II. Tự luận (2,5 điểm)
Câu 1: Hoàn thành dãy chuyển hóa sau
![]()
Câu 2: Cho một chiếc đinh sắt vào 20 ml dung dịch CuSO4 0,1 m. Sau phản ứng kết thúc, thấy có kim loại màu đỏ được tạo thành.
a) Viết phương trình hóa học của phản ứng xảy ra
b) Giả sử CuSO4 trong dung dịch phản ứng hết, tính khối lượng kim loại màu đỏ được tạo ra
ĐÁP ÁN
Phần trắc nghiệm
|
1C |
2D |
3D |
4B |
5C |
|
6B |
7C |
8D |
9B |
10B |
|
11A |
12C |
13B |
14C |
15D |
Câu 5:
n CaCO3 = 50 : 100 = 0,5 mol
Đáp án C
Câu 6:
Khối lượng đường = 120. 1,8% = 2,16g
Đáp án B
Câu 7:
CM = n : V => n CuSO4 = 0,5.0,1 = 0,05 mol
=> m CuSO4 = 0,05 . 160 = 8g
Đáp án D
Câu 8:
Dựa vào tỉ lệ phản ứng n HCl < n Mg => HCl hết
n H2 = 0,1 : 2 = 0,05 mol
V = 0,05 . 24,79 = 1,2395 lít
Đáp án C
Câu 9:
(a) sai vì dầu hỏa cháy và mất đi sau phản ứng
(b) đúng
(c) sai
(d) đúng
Đáp án B
Câu 13:
Đáp án B vì kim loại tác dụng với oxygen tạo oxide
II. Tự luận
Câu 1:
Câu 2:
nCuSO4 = CM x V = 0,1 x 20 x 10−3 = 2 x10−3 (mol)
a) PTHH: Fe + CuSO4 → FeSO4 + Cu
b) nCuSO4 = CM x V = 0,1 x 20 x 10−3 = 2 x10−3 (mol)
Theo PTHH: nCuSO4 = nCu
=> mCu = 2 x 10−3 x 64 = 0,128 (gam).
Đề thi giữa kì 1 Khoa học tự nhiên 8 Cánh diều có đáp án - Đề 3
Phòng Giáo dục và Đào tạo ...
Đề thi Giữa kì 1 - Cánh diều
Năm học 2024 – 2025
Môn: Khoa học tự nhiên 8
Thời gian làm bài: phút
(Đề số 3)
Câu 1: Cho các quá trình sau:
(a) Phân hủy copper (II) hydroxide thành copper (II) oxide và hơi nước.
(b) Đốt đèn cồn, cồn (ethalnol) cháy.
(c) Đun sôi nước.
(d) Quá trình quang hợp của cây xanh.
(e) Hòa tan KBr vào nước làm cho nước trở nên lạnh.
(f) Sulfuric acid đặc khi thêm vào nước làm cho nước nóng lên.
Số quá trình xảy ra biến đổi hóa học là
A. 2.
B. 3.
C. 1.
D. 4.
Câu 2: Phản ứng hóa học là quá trình biến đổi
A. nguyên tử này thành phân tử khác.
B. chất này thành chất khác.
C. nguyên tử này thành nguyên tử khác.
D. phân tử này thành nguyên tử khác.
Câu 3: Cho phản ứng: A + B ⟶ C + D. Công thức về khối lượng các chất là
A. mA + mB = mC + mD.
B. mB = mA + mB + mC.
C. mD = mA + mB + mC.
D. mA = mB + mC + mD.
Câu 4: Hệ số thích hợp cho phản ứng sau: P + O2 P2O5 lần lượt là
A. 3:2:1
B. 2:5:2
C. 1:5:1
D. 4:5:2
Câu 5: Số phân tử O3 trong 0,1 mol O3 là
A. 0,1.1023
B. 6,022.1023
C. 0,6022.1023
D. 60,22.1023
Câu 6: Cho 6,5 gam Zn phản ứng với HCl loãng, dư thu được muối ZnCl2 và khí H2. Số mol khí H2 thu được ở đkc sau phản ứng là
A. 0,2.
B. 0,1.
C. 0,3.
D. 0,4.
Câu 7: Cho 6,5 gam Zn tác dụng với dung dịch có chứa 14,6 gam HCl. Thể tích khí H2 (đkc) thu được là
A. 2,479 lít.
B. 1,2395 lít.
C. 3,7185 lít.
D. 4,958 lít.
Câu 8: Dung dịch là hỗn hợp
A. của chất rắn trong chất lỏng.
B. của hai chất lỏng.
C. của nước và chất lỏng.
D. đồng nhất của dung môi và chất tan.
Câu 9: Hòa tan hết 19,5g kali vào 261g nước. Nồng độ % của dung dịch thu được là (cho rằng nước bay hơi không kể)
A. 5%.
B. 20%.
C. 15%.
D. 10%.
Câu 10: Công thức tính nồng độ mol (CM) là
A.
B.
C.
D.
Câu 11: Các chất đốt như than, củi, … có kích thước nhỏ hơn sẽ cháy nhanh hơn. Yếu tố ảnh hưởng đến tốc độ phản ứng trên là
A. áp suất.
B. nhiệt độ.
C. nồng độ.
D. diện tích bề mặt.
Câu 12: Acid là gì?
A. Acid là tất cả những hợp chất trong phân tử có nguyên tử hydrogen. Khi tan trong nước, acid tạo ra ion H+.
B. Acid là những hợp chất trong phân tử có nguyên tử hydrogen liên kết với gốc acid. Khi tan trong nước, acid tạo ra ion H+.
C. Acid là những hợp chất trong phân tử có nguyên tử hydrogen liên kết với gốc acid. Khi tan trong nước, acid tạo ra ion H-.
D. Acid là những hợp chất trong phân tử có nguyên tử hydrogen liên kết với gốc acid. Khi tan trong nước, acid không tạo ra ion H+.
Câu 13: Phương trình phân li nào dưới đây sai?
A. HCl ⟶ H+ + Cl-
B. HNO3 ⟶ H+ + NO3-
C. HClO ⟶ H+ + ClO-
D. H2SO4 ⟶ H+ + HSO4-
Câu 14: Dung dịch base làm giấy quý tìm chuyền thành màu
A. đỏ.
B. xanh.
C. vàng.
D. không đổi màu.
Câu 15: Thang pH được dùng để
A. biểu thị độ mặn, nhạt của dung dịch.
B. biểu thị nồng độ cao, thấp của các chất tan trong dung dịch.
C. biểu thị độ acid, base của dung dịch.
D. biểu thị màu sắc của dung dịch.
Câu 16: Oxide là hợp chất của oxygen với
A. kim loại.
B. phi kim.
C. khí hiếm.
D. nguyên tố khác.
Câu 17: Trong tự nhiên, muối ăn được thấy nhiều trong đâu?
A. Trong đất.
B. Trong nước biển.
C. Trong mỏ quặng.
D. Trong các nguồn nước.
Câu 18: Hợp chất nào dưới đây là muối?
A. HCl.
B. P2O5.
C. AgC
D. Ag2O.
Câu 19: Phân NPK là
A. phân hỗn hợp.
B. phân lân.
C. phân đạm
D. phân kali.
Câu 20: Cho các dung dịch sau: NaOH, NaHCO3, HNO3, KNO3, FeSO4, H3PO4, HCN. Số dung dịch là quỳ tím hóa đỏ là
A. 1.
B. 2.
C. 3.
D. 4.
----- HẾT -----
Đáp án
|
1.B |
2.B |
3.A |
4.D |
5.C |
6.B |
7.A |
8.D |
9.D |
10.C |
|
11.D |
12.B |
13.D |
14.B |
15.C |
16.D |
17.B |
18.C |
19.A |
20.C |
Câu 1:
Lời giải chi tiết
(a), (b), (d) là quá trình xảy ra biến đổi hóa học.
Chọn B.
Câu 2:
Lời giải chi tiết
Phản ứng hóa học là quá trình biến đổi chất này thành chất khác.
Chọn B.
Câu 3:
Lời giải chi tiết
Công thức về khối lượng các chất là mA + mB = mC + mD.
Chọn A.
Câu 4:
Cách giải:
4P + 5O2 2P2O5
Hệ số thích hợp cho phản ứng là: 4:5:2
Chọn D.
Câu 5:
Lời giải chi tiết
Số phân tử O3 trong 0,1 mol O3 là = 0,1.6,022.1023 = 0,6022.1023
Chọn C.
Câu 6:
Lời giải chi tiết
nZn = 6,5:65 = 0,1 mol
Zn + 2HCl ⟶ ZnCl2 + H2
0,1 ⟶ 0,1
⟹ nH2 = 0,1 mol
Chọn B.
Câu 7:
Lời giải chi tiết
Zn + 2HCl ⟶ ZnCl2 + H2
nZn = 0,1 mol
nHCl = 0,4 mol
Theo PTHH: nHCl = 2nZn = 0,2 mol
⟹ HCl dư, Zn hết
nH2 = nZn = 0,1 mol
VH2 = 0,1.24,79 = 2,479 lít
Chọn A.
Câu 8:
Lời giải chi tiết
Dung dịch là hỗn hợp đồng nhất của dung môi và chất tan.
Chọn D.
Câu 9:
Phương pháp giải
C% = mct/mdd.100%
Lời giải chi tiết
K + H2O ⟶ KOH + ½ H2
nK = 19,5/39 = 0,5 mol
⟹ nH2 = 0,25 mol
mdd = 19,5 + 261 – mH2 = 19,5 + 261 – 0,25.2 = 280 gam
C%KOH = (0,5.56/280).100% = 10%
Chọn D.
Câu 10:
Lời giải chi tiết
Công thức tính nồng độ mol (CM) là CM = n/V
Với n là số mol, V là thể tích của dung dịch (lít)
Chọn C.
Câu 11:
Lời giải chi tiết
Chất đốt có kích thước nhỏ hơn cháy nhanh hơn ⟹ Đây là yếu tố diện tích bề mặt.
Chọn D.
Câu 12:
Lời giải chi tiết
Acid là những hợp chất trong phân tử có nguyên tử hydrogen liên kết với gốc acid. Khi tan trong nước, acid tạo ra ion H+.
Chọn B.
Câu 13:
Lời giải chi tiết
D sai, vì H2SO4 ⟶ 2H+ + SO42-
Chọn D.
Câu 14:
Lời giải chi tiết
Dung dịch base làm giấy quý tìm chuyền thành màu xanh.
Chọn B.
Câu 15:
Lời giải chi tiết
Thang pH được dùng để biểu thị độ acid, base của dung dịch.
Chọn C.
Câu 16:
Lời giải chi tiết
Oxide là hợp chất của oxygen với nguyên tố khác.
Chọn D.
Câu 17:
Lời giải chi tiết
Muối ăn có nhiều trong nước biển.
Chọn B.
Câu 18:
Lời giải chi tiết
Muối: AgCl.
Chọn C.
Câu 19:
Lời giải chi tiết
Phân NPK là phân hỗn hợp, chứa ba thành phần dinh dưỡng: đạm, lân, kali.
Chọn A.
Câu 20:
Lời giải chi tiết
Dung dịch làm quỳ tím hóa đỏ: HNO3, H3PO4, HCN.
⟶ Có 3 dung dịch.
Chọn C.