Sắt(III) oxit có công thức là Fe2O3, đây là một trong các hợp chất quan trọng của sắt. Fe2O3 có nhiều trong quặng hematit - nguồn cung cấp sắt cho ngành công nghiệp gang, thép. Bài viết sau đây, sẽ giúp các em biết cách nhận biết Fe2O3 trong bài tập nhận biết.
Cách nhận biết Fe2O3
I. Cách nhận biết Fe2O3
Fe2O3 là chất rắn, có màu nâu đỏ và không tan trong nước.

- Cách nhận biết: Hòa tan Fe2O3 trong dung dịch HCl.
- Hiện tượng: Chất rắn tan ra, dung dịch có màu vàng nâu.
- Phương trình hóa học:
Fe2O3 + 6HCl → 2FeCl3 + 3H2O
II. Mở rộng
- Sắt(III) oxit có thể được điều chế bằng phản ứng phân hủy Fe(OH)3 ở nhiệt độ cao:
2Fe(OH)3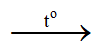 Fe2O3 + 3H2O
Fe2O3 + 3H2O
- Sắt(III) oxit có trong tự nhiên dưới dạng quặng hematit dùng để luyện gang.
III. Bài tập minh họa
Bài 1: Chỉ dùng một thuốc thử, hãy phân biệt 2 gói chất rắn sau: Fe2O3 và hỗn hợp (Fe + Fe2O3)? Viết phương trình hóa học minh họa.
Hướng dẫn giải:
- Trích mẫu thử.
- Cho lần lượt từng mẫu thử tác dụng với lượng dư HCl
+ Mẫu thử tan dần, thu được dung dịch có màu vàng nâu, không có khí thoát ra → mẫu thử là Fe2O3.
Fe2O3 + 6HCl → 2FeCl3 + 3H2O
+ Mẫu thử tan dần, kèm theo có khí thoát ra → mẫu thử là hỗn hợp (Fe; Fe2O3)
Fe + 2HCl → FeCl2 + H2↑
Fe2O3 + 6HCl → 2FeCl3 + 3H2O
Bài 2: Có một lượng nhỏ bột sắt(III) oxit bị lẫn tạp chất là vụn sắt. Trình bày cách tách vụn sắt ra khỏi mẫu để thu được sắt(III) oxit tinh khiết.
Hướng dẫn giải:
Sắt bị nam châm hút, còn sắt(III) oxit không bị nam châm hút. Do đó có thể sử dụng nam châm để hút vụn sắt ra khỏi mẫu để được sắt(III) oxit tinh khiết.
Xem thêm cách nhận biết các chất hóa học nhanh, chi tiết khác: