Tailieumoi.vn xin giới thiệu đến các quý thầy cô, các em học sinh đang trong quá trình ôn tập tài liệu Lý thuyết, bài tập về nguyên tử có đáp án môn Hóa học lớp 8, tài liệu bao gồm 6 trang, đầy đủ lý thuyết, phương pháp giải chi tiết và bài tập có đáp án (có lời giải), giúp các em học sinh có thêm tài liệu tham khảo trong quá trình ôn tập, củng cố kiến thức và chuẩn bị cho bài thi môn Hóa học sắp tới. Chúc các em học sinh ôn tập thật hiệu quả và đạt được kết quả như mong đợi.
Mời các quý thầy cô và các em học sinh cùng tham khảo và tải về chi tiết tài liệu dưới đây:
Dạng 1
Lý thuyết về cấu tạo nguyên tử
* Một số lưu ý cần nhớ
|
1. Nguyên tử : Là hạt vô cùng nhỏ, trung hòa về điện. Nguyên tử gồm hạt nhân mang điện tích dương và vỏ tạo bởi các electron mang điện tích âm. 2. Hạt nhân nguyên tử : Được tạo ra bởi các proton và nơtron. Trong mỗi nguyên tử, số proton (p, +) bằng số electron (e, -). Tức là
- Hạt proton và notron có khối lượng tương đương nhau, còn hạt electron có khối lượng rất bé, không đáng kể. => Vì vậy, khối lượng hạt nhân được coi là khối lượng nguyên tử 3. Lớp electron : Electron luôn chuyển động quanh hạt nhân và sắp xếp thành từng lớp. Các nguyên tử có thể liên kết với nhau nhờ electron. |
* Một số ví dụ điển hình
Ví dụ 1: Trong nguyên tử, hạt mang điện là
A. proton
B. proton và hạt nhân
C. proton và electron
D. proton và notron
Hướng dẫn giải chi tiết
Trong nguyên tử, hạt mang điện là hạt proton (+) và electron (-)
Đáp án C
Ví dụ 2: Nguyên tử trung hòa về điện vì
A. số proton bằng số electron
B. số proton bằng số electron
C. số notron bằng số electron
D. có cùng số proton
Hướng dẫn giải chi tiết
Nguyên tử trung hòa về điện vì có số proton bằng số electron.
Đáp án A
Ví dụ 3: Để biểu thị khối lượng của một nguyên tử, người ta dùng đơn vị
A. gam
B. miligam
C. kilogam
D. đvC
Hướng dẫn giải chi tiết
Để biểu thị khối lượng của một nguyên tử, người ta dùng đơn vị đvC
Đáp án D
Ví dụ 4: Trong khoảng không gian giữa hạt nhân và lớp vỏ electron của nguyên tử có những gì?
A. Electron
B. Notron
C. Proton
D. Không có gì
Hướng dẫn giải chi tiết:
Nguyên tử có cấu tạo rỗng => có khoảng không gian trống giữa hạt nhân và lớp vỏ electron của nguyên tử
Đáp án D.
Dạng 2
Tính khối lượng của nguyên tử
* Một số lưu ý cần nhớ
|
- Ta có khối lượng của 1 hạt proton là 1,6726 . 10-24 gam. Khối lượng của 1 hạt notron là 1,675 . 10-24 gam, khối lượng của 1 hạt electron là 9,1 . 10 -28 gam. Gọi mp, mn, me lần lượt là khối lượng của proton, notron, electron => m nguyên tử = mp + mn + me Vì khối lượng electron rất nhỏ, nên ta coi khối lượn nguyên tử bằng khối lượng của hạt nhân. |
* Một số ví dụ điển hình
Ví dụ 1: Một nguyên tử nhôm (Al) có 13 proton, 13 electron và 14 notron. Hãy xác định khối lượng của một nguyên tử nhôm.
Hướng dẫn giải chi tiết
Ta có mp = 13 . 1,6726 . 10-24 = 21,71.10-24 gam
mn = 14 . 1,675 . 10-24 = 23,45.10-24 gam
me = 13 . 9,1 . 10-28 = 0,01183 . 10-24 gam
=> Khối lượng 1 nguyên tử nhôm là:
mp + mn + me = 21,71.10-24 + 23,45.10-24 + 0,01183 . 10-24 = 45,172 . 10-24 gam
Ví dụ 2: Hạt nhân nguyên tử oxi có chứa 8 notron và 8 proton. Hãy tính khối lượng nguyên tử oxi theo đơn vị gam.
Hướng dẫn giải chi tiết
Ta có: đối với 1 nguyên tử, khối lượng của hạt nhân xấp xỉ bằng khối lượng của nguyên tử
=> m nguyên tử O = mp + mn = 8 . 1,672 . 10-24 + 8 . 1,675 . 10-24 = 26,776 . 10-24 gam
Dạng 3
Xác định số proton, notron và số electron của nguyên tử
* Một số lưu ý cần nhớ
|
- Trong một nguyên tử có số p = số e (1) Gọi số p, số e, số n có trong nguyên tử lần lượt là p, e, n => Tổng số hạt có trong X là: p + e + n (2) Từ (1) và (2) => Tổng số hạt có trong X là 2p + n Kết hợp với các dữ kiện trong đề bài để giải hệ phương trình => số p, n , e |
* Một số ví dụ điển hình:
Ví dụ 1: Nguyên tử của nguyên tố X có tổng số hạt là 40. Tổng số hạt mang điện nhiều hơn tổng số hạt không mang điện là 12 hạt. Nguyên tử X có số proton là:
Hướng dẫn giải chi tiết:
Nguyên tử của nguyên tố X có tổng số hạt là 40.
Tổng số hạt = p + e + n = 2p + n = 40 (1)
Số hạt mang điện nhiều hơn số hạt không mang điện là 12
=> p + e – n = 2p – n = 12 (2)
Từ (1) và (2) => p = 13; n = 14
Số proton có trong nguyên tử X bằng 13
Ví dụ 2: Tổng số hạt của nguyên tử nguyên tố T là 60. Số hạt mang điện gấp đôi số hạt không mang điện. Số hạt nơtron trong nguyên tử nguyên tố T là:
Hướng dẫn giải chi tiết:
Vì tổng số hạt của nguyên tử nguyên tố T là 60 nên
p + e + n = 60 → 2p + n = 60 (1)
Vì số hạt mang điện gấp đôi số hạt không mang điện nên
p + e = 2n → 2p = 2n → p – n = 0 (2)
Giải hệ (1) và (2) ta có: p = 20 và n = 20
Vậy số hạt nơtron trong nguyên tử nguyên tố T là 20.
Ví dụ 3: Nguyên tử nguyên tố Y có tổng số hạt cơ bản là 40 hạt. Trong hạt nhân của Y, số hạt mang điện ít hơn số hạt không mang điện là 1 hạt. Y có số proton là:
Hướng dẫn giải chi tiết:
Nguyên tử nguyên tố Y có tổng số hạt cơ bản là 40 hạt
=> p + n + e = 2p + n = 40 (1)
Trong hạt nhân Y có số hạt mang điện ít hơn số hạt không mang điện là 1 hạt
=> n – p = 1 (2)
Từ (1) và (2) => p = 13, n = 14
Số proton có trong Y bằng 13.
Dạng 4
Xác định, viết sơ đồ cấu tạo của một nguyên tử
* Một số lưu ý cần nhớ:
|
- Để viết sơ đồ electron nguyên tử, ta dùng đường tròn để biểu diễn. Mỗi vòng tròn là một lớp electron. Người ta qui ước số electron có trong một lớp - Lớp thứ nhất chứa tối đa 2 electron - Lớp thứ hai chứa tối đa 8 electron… Mỗi electron được biểu thị bằng một dấu tròn đậm. |
* Một số ví dụ điển hình
Ví dụ 1: Nguyên tử Z có 16 proton trong hạt nhân. Hãy vẽ cấu tạo của nguyên tử Z.
Hướng dẫn giải chi tiết
Trong hạt nhân có số p = số e = 16
=> Lớp 1 có 2 electron, lớp 2 có 8 electron, lớp 3 có 6 electron.
Ta có sơ đồ:
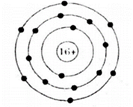
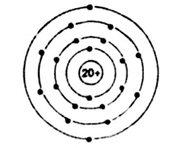
Ví dụ 2: Cho sơ đồ hình vẽ như sau:
a, Hãy chỉ ra số proton, số electron trong nguyên tử.
b, Số lớp electron, số e lớp ngoài cùng có trong nguyên tử
Hướng dẫn giải chi tiết:
a, Trong nguyên tử, số proton = số electron = 20
b, chất này có số lớp e là 4, và có 2 electron lớp ngoài cùng
* Bài tập vận dụng
Bài 1: Nguyên tử Nhôm có điện tích hạt nhân là 13+. Trong nguyên tử Al số hạt mang điện nhiều hơn số hạt không mang điện là 12 hạt. Số khối của Al là:
A. 13 B. 14
C. 27 D. 26
Lời giải:
Điện tích hạt nhân là 13+ ⇒ p = 13
Số hạt mang điện là p và e; số hạt không mang điện là n
⇒ p + e – n = 12
Mà p = e ⇒ 2p – e = 12
Thay p = 13 ⇒ n = 26 – 12 = 14
⇒ A = p + n = 13 + 14 = 27
⇒ Đáp án C
Bài 2: Biết nguyên tử B có tổng số hạt là 21. Số hạt không mang điện chiếm 33,33%. Kí hiệu nguyên tử B là:
Lời giải:
Số hạt không mang điện chiếm 33,33% ⇒ % n = 33,33;
Tổng số hạt = 21
⇒ n = 33,33%.21 = 7 (1)
Ta có: p + n + e = 21 mà p = e ⇒ 2p + n = 21 (2)
Thay n = 21 ⇒ p = e = (21−7) : 2 = 7
A = p + n = 7 + 7 = 14; Z = p = e = 7
⇒ Kí hiệu nguyên tử B:
⇒ Đáp án A
Bài 3: Tổng số hạt trong nguyên tử X là 28. Số hạt p, n, e của X lần lượt là:
A. 8; 12; 8
B. 9; 10; 9
C. Không xác định được
D. Cả A và B
Lời giải:
Tổng số hạt = 28 ⇒ p + n + e = 28 ⇒ 2p + n = 28
Ta có: p < n < 1,5p
⇒ 3p ≤ 2p + n = 28 ≤ 3,5p
⇒ 8 ≤ p ≤ 9,3 mà p ∈ N
⇒ Đáp án D





