Tailieumoi.vn xin giới thiệu Trắc nghiệm Hóa học lớp 10 Bài 10: Quy tắc octet sách Kết nối tri thức. Bài viết gồm 20 câu hỏi trắc nghiệm với đầy đủ các mức độ và có hướng dẫn giải chi tiết sẽ giúp học sinh ôn luyện kiến thức và rèn luyện kĩ năng làm bài trắc nghiệm Hóa học 10. Ngoài ra, bài viết còn có phần tóm tắt nội dung chính lý thuyết Bài 10: Quy tắc octet. Mời các bạn đón xem:
Trắc nghiệm Hóa học 10 Bài 10: Quy tắc octet
Phần 1: Trắc nghiệm Quy tắc octet
Câu 1. Nguyên tố aluminium thuộc nhóm IIIA. Số electron hóa trị của nguyên tử nguyên tố aluminium là
A. 1.
B. 2.
C. 3.
D. 4.
Đáp án: C
Giải thích:
Số electron hóa trị = Số thứ tự nhóm A = 3.
Nguyên tử aluminium có 3 electron hóa trị.
Câu 2. Nguyên tử chlorine có Z = 17. Số electron hóa trị của nguyên tử chlorine là
A. 3.
B. 5.
C. 6.
D. 7.
Đáp án: D
Giải thích:
Cấu hình electron của nguyên tử chlorine (Z = 17): 1s22s22p63s23p5.
Electron cuối cùng điền vào phần lớp p Chlorine thuộc nhóm A.
Số electron hóa trị = Số electron lớp ngoài cùng = 7.
Câu 3. Khi nguyên tử oxygen nhận thêm 2 electron thì ion tạo thành có cấu hình electron của nguyên tử nguyên tố nào?
A. Carbon.
B. Neon.
C. Sodium.
D. Argon.
Đáp án: B
Giải thích:
Nguyên tử oxygen có Z = 8 = Số proton = Số electron.
Nguyên tử oxygen nhận thêm 2 electron để tạo thành ion có 10 electron có cấu hình giống nguyên tử nguyên tố khí hiếm Argon (Ar4): 1s22s22p6.
Câu 4. Nguyên tử Na nhường đi 1 electron thì ion tạo thành có cấu hình electron của nguyên tử nguyên tố nào?
A. Oxygen.
B. Carbon.
C. Magnesium.
D. Neon.
Đáp án: D
Giải thích:
Nguyên tử Na có Z = 11 = Số proton = Số electron.
Nguyên tử Na nhường 1 electron để tạo thành ion có 10 electron có cấu hình giống nguyên tử nguyên tố khí hiếm Argon (Ar): 1s22s22p6.
Câu 5. Quy tắc octet:
A. Khi hình thành liên kết hóa học, các nguyên tử có xu hướng nhường, nhận hoặc góp chung electron để đạt tới cấu hình electron bền vững của nguyên tử khí hiếm.
B. Khi hình thành liên kết hóa học, các nguyên tử có xu hướng nhường, nhận hoặc góp chung electron để đạt tới cấu hình electron của nguyên tử chlorine.
C. Khi hình thành liên kết hóa học, các nguyên tử có xu hướng vừa nhường, vừa nhận electron để đạt tới cấu hình electron bền vững của nguyên tử khí hiếm.
D. Khi hình thành liên kết hóa học, các nguyên tử có xu hướng vừa nhường, vừa nhận electron để đạt tới cấu hình electron của nguyên tử chlorine.
Đáp án: A
Giải thích:
Khi hình thành liên kết hóa học, các nguyên tử có xu hướng nhường, nhận hoặc góp chung electron để đạt tới cấu hình electron bền vững của nguyên tử khí hiếm. Vì các khí hiếm (trừ helium) đều có 8 electron lớp ngoài cùng nên quy tắc này được gọi là quy tắc octet.
Câu 6. Theo thuyết cấu tạo hóa học, sự liên kết giữa các nguyên tử tạo thành phân tử hay tinh thể được giải thích bằng
A. sự giảm năng lượng khi các nguyên tử kết hợp lại với nhau.
B. sự tăng năng lượng khi các nguyên tử kết hợp lại với nhau.
C. sự giảm bán kính nguyên tử khi các nguyên tử kết hợp lại với nhau.
D. sự tăng bán kính nguyên tử khi các nguyên tử kết hợp lại với nhau.
Đáp án: A
Giải thích:
Theo thuyết cấu tạo hóa học, sự liên kết giữa các nguyên tử tạo thành phân tử hay tinh thể được giải thích bằng sự giảm năng lượng khi các nguyên tử kết hợp lại với nhau.
Câu 7. Khi tạo liên kết hóa học thì nguyên tử có xu hướng
A. đạt tới cấu hình electron bền vững của khí hiếm He.
B. đạt tới cấu hình electron bền vững của khí hiếm.
C. nhường electron để tạo thành ion dương.
D. nhận electron để tạo thành ion âm.
Đáp án: B
Giải thích:
Khi tạo liên kết hóa học thì nguyên tử có xu hướng đạt tới cấu hình electron bền vững của khí hiếm.
Câu 8. Liên kết hóa học là
A. là sự kết hợp giữa hai nguyên tử phi kim để tạo thành phân tử bền vững hơn.
B. là sự trao đổi electron giữa các nguyên tử tạo thành phân tử.
C. sự kết hợp giữa các nguyên tử tạo thành ion đa nguyên tử.
D. sự kết hợp giữa các nguyên tử tạo thành phân tử hay tinh thể bền vững hơn.
Đáp án: D
Giải thích:
Liên kết hóa học là sự kết hợp giữa các nguyên tử tạo thành phân tử hay tinh thể bền vững hơn.
Câu 9. Trong các phản ứng hóa học, các electron nào tham gia vào quá trình tạo thành liên kết?
A. chỉ có các electron thuộc phân lớp s.
B. chỉ có các electron thuộc phân lớp p.
C. chỉ có các electron thuộc lớp ngoài cùng và phân lớp sát ngoài cùng.
D. chỉ có các electron thuộc lớp trong cùng.
Đáp án: C
Giải thích:
Trong các phản ứng hóa học, chỉ có các electron thuộc lớp ngoài cùng và phân lớp sát lớp ngoài cùng tham gia vào quá trình tạo thành liên kết.
Câu 10. Nguyên tử Mg có 2 electron hóa trị, được biểu diễn là
A. –Mg–
B. Mg=
C. Mg :
D. : Mg
Đáp án: C
Giải thích:
Các electron hóa trị của nguyên tử một nguyên tố được quy ước biểu diễn bằng các dấu chấm đặt xung quanh kí hiệu nguyên tố.
Nguyên tử Mg có 2 electron hóa trị. Biểu diễn như sau: Mg
Câu 11. Khi hình thành liên kết hóa học, nguyên tử kim loại nhường electron để tạo thành
A. ion âm.
B. ion dương.
C. ion đa nguyên tử mang điện tích âm.
D. ion đa nguyên tử mang điện tích dương.
Đáp án: B
Giải thích:
Khi hình thành liên kết hóa học, nguyên tử kim loại nhường electron để tạo thành ion dương.
Ví dụ: Nguyên tử Na nhường 1 electron để tạo thành ion dương.
Na → Na+ + 1e
Câu 12. Khi hình thành liên kết hóa học, nguyên tử phi kim nhận electron để tạo thành
A. ion âm.
B. ion dương.
C. ion đa nguyên tử mang điện tích âm.
D. ion đa nguyên tử mang điện tích dương.
Đáp án: A
Giải thích:
Khi hình thành liên kết hóa học, nguyên tử phi kim nhận electron để tạo thành ion âm.
Ví dụ:
Cl + 1e → Cl-
Câu 13. Khi hình thành liên kết hóa học trong phân tử Cl2, mỗi nguyên tử chlorine
A. góp chung 1 electron.
B. góp chung 2 electron.
C. góp chung 3 electron.
D. góp chung 4 electron.
Đáp án: A
Giải thích:
Cấu hình electron của nguyên tử Cl (Z = 17): [Ne]3s23p5.
Khi hình thành liên kết hóa học trong phân tử Cl2, nguyên tử Cl có 7 electron hóa trị, mỗi nguyên tử Cl cần thêm 1 electron để đạt cấu hình electron bão hòa theo quy tắc octet nên mỗi nguyên tử Cl góp chung 1 electron.
Phân tử Cl2 được biểu diễn:

Xung quanh mỗi nguyên tử Cl đều có 8 electron.
Câu 14. Khi hình thành liên kết hóa học trong phân tử H2O,
A. mỗi nguyên tử hydrogen cần thêm 2 electron và nguyên tử oxygen cần thêm 1 electron.
B. mỗi nguyên tử hydrogen cần thêm 1 electron và nguyên tử oxygen cần thêm 2 electron.
C. mỗi nguyên tử hydrogen cần thêm 2 electron và nguyên tử oxygen cần thêm 2 electron.
D. mỗi nguyên tử hydrogen cần thêm 1 electron và nguyên tử oxygen cần thêm 1 electron.
Đáp án: B
Giải thích:
Cấu hình electron của nguyên tử H (Z = 1): 1s1.
Cấu hình electron của nguyên tử O (Z = 8): 1s22s22p4.
Khi hình thành liên kết hóa học trong phân tử H2O, nguyên tử hydrogen có 1 electron hóa trị, nguyên tử oxygen có 6 electron hóa trị, mỗi nguyên tử hydrogen cần thêm 1 electron (để đạt cấu hình bền vững của khí hiếm He) và nguyên tử oxygen cần thêm 2 electron (để đạt cấu hình bền vững của khí hiếm Ne).
Câu 15. Khi hình thành liên kết hóa học trong phân tử NaF:
A. nguyên tử Na nhận 1 electron hóa trị tạo thành hạt mang điện tích âm, nguyên tử F nhường 1 electron tạo thành hạt mang điện tích dương.
B. nguyên tử Na nhận 1 electron hóa trị tạo thành hạt mang điện tích dương, nguyên tử F nhường 1 electron tạo thành hạt mang điện tích âm.
C. nguyên tử Na nhường 1 electron hóa trị tạo thành hạt mang điện tích dương, nguyên tử F nhận 1 electron tạo thành hạt mang điện tích âm.
D. nguyên tử Na nhường 1 electron hóa trị tạo thành hạt mang điện tích âm, nguyên tử F nhận 1 electron tạo thành hạt mang điện tích dương.
Đáp án: C
Giải thích:
Cấu hình electron của nguyên tử:
Na (Z = 11): [Ne]3s1 có 1 electron lớp ngoài cùng.
F (Z = 9): 1s22s22p5 có 7 electron lớp ngoài cùng.
Khi hình thành liên kết hóa học trong phân tử NaF, nguyên tử Na có 1 electron hóa trị, nguyên tử F có 7 electron hóa trị, nguyên tử Na nhường 1 electron hóa trị tạo thành hạt mang điện tích dương, nguyên tử F nhận 1 electron tạo thành hạt mang điện tích âm. Các hạt này đều đạt cấu hình electron bão hòa theo quy tắc octet và có điện tích trái dấu nên hút nhau.
Phần 2: Lý thuyết Quy tắc octet
I. Khái niệm liên kết hóa học
Liên kết hóa học là sự kết hợp giữa các nguyên tử tạo thành phân tử hay tinh thể bền vững hơn.
Trong các phản ứng hóa học, chỉ có các electron thuộc lớp ngoài cùng và phân lớp sát lớp ngoài cùng tham gia vào quá trình tạo thành liên kết.
Các electron hóa trị của nguyên tử một nguyên tố được quy ước biểu diễn bằng các dấu chấm đặt xung quanh kí hiệu nguyên tố.
Ví dụ:
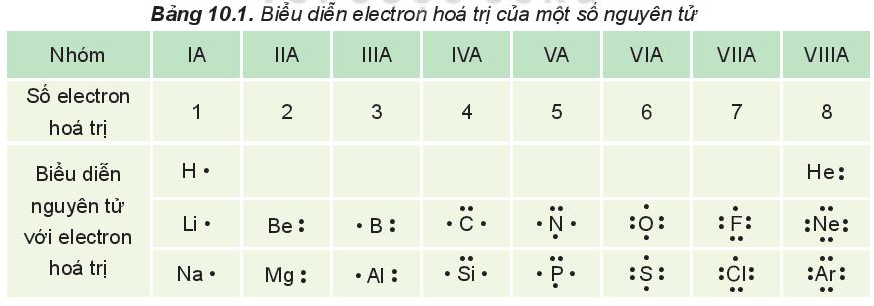
II. Quy tắc octet
Khi hình thành liên kết hóa học, các nguyên tử có xu hướng nhường, nhận hoặc góp chung electron để đạt tới cấu hình electron bền vững của nguyên tử khí hiếm. Vì các khí hiếm (trừ helium) đều có 8 electron lớp ngoài cùng nên quy tắc này được gọi là quy tắc octet.
Ví dụ 1: Xét sự hình thành liên kết hóa học trong phân tử Cl2.
Cấu hình electron của nguyên tử Cl (Z = 17): [Ne]3s23p5.
Khi hình thành liên kết hóa học trong phân tử Cl2, nguyên tử Cl có 7 electron hóa trị, mỗi nguyên tử Cl cần thêm 1 electron để đạt cấu hình electron bão hòa theo quy tắc octet nên mỗi nguyên tử Cl góp chung 1 electron.
Phân tử Cl2 được biểu diễn:

Xung quanh mỗi nguyên tử Cl đều có 8 electron.
Ví dụ 2: Xét sự hình thành liên kết hóa học trong phân tử NaF.
Cấu hình electron của nguyên tử:
Na (Z = 11): [Ne]3s1 có 1 electron lớp ngoài cùng.
F (Z = 9): 1s22s22p5 có 7 electron lớp ngoài cùng.
Khi hình thành liên kết hóa học trong phân tử NaF, nguyên tử Na có 1 electron hóa trị, nguyên tử F có 7 electron hóa trị, nguyên tử Na nhường 1 electron hóa trị tạo thành hạt mang điện tích dương, nguyên tử F nhận 1 electron tạo thành hạt mang điện tích âm. Các hạt này đều đạt cấu hình electron bão hòa theo quy tắc octet và có điện tích trái dấu nên hút nhau.
Xem thêm các bài trắc nghiệm Hóa học 10 Kết nối tri thức hay, chi tiết khác:
Trắc nghiệm Bài 9: Ôn tập chương 2
Trắc nghiệm Bài 10: Quy tắc octet
Trắc nghiệm Bài 11: Liên kết ion
Trắc nghiệm Bài 12: Liên kết cộng hóa trị
Trắc nghiệm Bài 13: Liên kết hydrogen và tương tác van der Waals