Tailieumoi.vn sưu tầm và biên soạn chuyên đề Axit nitric và muối nitrat gồm đầy đủ lý thuyết, các dạng bài tập chọn lọc và ví dụ minh họa từ cơ bản đến nâng cao giúp học sinh ôn luyện kiến thức, biết cách làm bài tập môn Hóa học 11.
Chuyên đề Axit nitric và muối nitrat
I. LÍ THUYẾT TRỌNG TÂM
AXIT NITRIC
1. Cấu tạo phân tử
Công thức cấu tạo:
Trong phân tử : N có số oxi hóa +5.
2. Tính chất vật lí
Axit nitric tinh khiết là chất lỏng không màu, bốc khói mạnh trong không khí ẩm, , sôi ở .
|
Trong điều kiện thường, dung dịch có màu hơi vàng do bị phân hủy chậm thành :
Phải đựng dung dịch trong bình tối màu. |
3. Tính chất hoá học
là axit mạnh.
Số oxi hóa cao nhất nên chỉ có thể giảm tính oxi hoá.
a. Tính axit: là axit mạnh
Làm quỳ tím hoá đỏ
Tác dụng với oxit bazơ, bazơ, muối của các axit yếu Muối nitrat.
|
Ví dụ:
|
b. Tính oxi hóa
có số oxi hóa +5 có thể bị khử thành:
tuỳ theo nồng độ và khả năng khử của chất tham gia.
Oxi hoá hầu hết kim loại (trừ Au, Pt).
Chú ý: Fe, Al, Cr thụ động hoá với đặc, nguội.
|
Ví dụ:
Thường loãng tạo thành NO; đặc tạo thành . |
đặc, nóng oxi hóa được một số phi kim C, S, P,... giải phóng .
|
Ví dụ: Khi đun nóng, đặc có thể oxi hóa một số phi kim lên mức oxi hóa cao nhất. Thí nghiệm: đặc với C, S:
|
đặc oxi hoá nhiều hợp chất vô cơ và hữu cơ.
|
Ví dụ: Vải, giấy, mùn cưa, dầu thông... bị phá hủy khi tiếp xúc đặc. Ví dụ:
|
4. Điều chế
a. Trong phòng thí nghiệm
Cho tinh thể (hoặc ) tác dụng với đặc, đun nóng.
b. Trong công nghiệp
Sản xuất từ , không khí: Gồm 3 giai đoạn
• Oxi hoá khí bằng oxi không khí thành NO:
• Oxi hoá NO thành NO2 bằng oxi không khí ở điều kiện thường
• tác dụng với nước và oxi không khí tạo
|
Dung dịch có nồng độ 52 - 68% Để có nồng độ cao hơn: Chưng cất với H2SO4 đậm đặc. |
MUỐI NITRAT:
1. Tính chất của muối nitrat
a. Tính chất vật lí
Tất cả các muối nitrat đều tan trong nước và là chất điện li mạnh.
|
Ví dụ:
|
b. Tính chất hoá học
Các muối nitrat đều kém bền bởi nhiệt, khi đun nóng ở nhiệt độ cao muối nitrat có tính oxi hóa mạnh.
Sản phẩm phân huỷ phụ thuộc vào bản chất của cation kim loại.
• Kim loại đứng trước Mg (trừ Ba) Muối nitrit + O2
|
Ví dụ: Chú ý: |
• Từ Mg đến Cu Oxit kim loại + + O2
|
Ví dụ: |
• Kim loại sau Cu Kim loại + + O2
|
Ví dụ: |
2. Nhận biết ion nitrat
Sử dụng (hoặc HCl):
Hiện tượng: Dung dịch thu được có màu xanh, khí không màu hóa nâu trong không khí thoát ra.
3. Ứng dụng
Các muối nitrat được sử dụng chủ yếu làm phân bón hóa học (phân đạm).
Kali nitrat ( ) được sử dụng để chế thuốc nổ đen.
SƠ ĐỒ HỆ THỐNG HÓA
AXIT NITRIC VÀ MUỐI NITRAT
I. AXIT NITRIC
1. Tính chất hóa học
Sản phầm khử:
Fe, Al, Cr bị thụ động hóa trong HNO3 đặc, nguội.
Ví dụ:
2. Điều chế
II. Muối nitrat
1. Phản ứng nhiệt phân
I:
II:
III:
2. Nhận biết
II. CÁC DẠNG BÀI TẬP
Dạng 1: Câu hỏi lí thuyết
Ví dụ mẫu
Ví dụ 1: Viết các phương trình phản ứng thực hiện dãy chuyển hoá sau:
Hướng dẫn giải
Sơ đồ hoàn chỉnh:
Phương trình hóa học:
(1)
(2)
(3)
(4)
(5)
(6)
(7)
Ví dụ 2: Phương trình hóa học nào sau đây sai?
A.
B.
C.
D.
Hướng dẫn giải
là muối của kim loại đứng trước Mg nên bị nhiệt phân thành muối nitrit và oxi.
Vậy phương trình hóa học sai là:
Chọn C.
III. Bài tập tự luyện dạng 1
Câu 1: Dãy gồm các kim loại đều tác dụng với đặc, nguội là:
A. Cu, Ag, Zn, Al. B. Cu, Ag, Zn, Pb.
C. Fe, Sn, Zn, Al. D. Fe, Zn, Al, Pb.
Câu 2: Để phân biệt ba dung dịch loãng: , ta dùng
A. Fe và Al. B. Cu và .
C. và NaOH. D. và KCl
Câu 3: Kim loại tác dụng không tạo ra
A. NO. B. N2.
C. . D. .
Câu 4: Dung dịch axit nitric tinh khiết để ngoài ánh sáng lâu ngày sẽ chuyển dần sang màu
A. vàng. B. đen sẫm.
C. trắng đục. D. đỏ.
Câu 5: Để điều chế trong phòng thí nghiệm, các hoá chất cần sử dụng là
A. tinh thể và đặc.
B. tinh thể và HCl đặc.
C. dung dịch và HCl đặc.
D. dung dịch và đặc.
Câu 6: Khi cho C tác dụng với đặc, nóng ta thu được các sản phẩm là:
A. B.
C. D.
Câu 7: Nhiệt phân hoàn toàn thu được các sản phẩm là:
A. B.
C. D.
Câu 8: Nhiệt phân hoàn toàn AgNO3 thu được các sản phẩm là:
A. . B. .
C. D.
Câu 9: Để phân biệt ba dung dịch không màu: và Na2SO4 đựng trong các lọ mất nhãn ta dùng
A. NaOH. B. .
C. D.
Câu 10: Cho Cu tác dụng với đặc tạo ra khí có đặc điểm nào sau đây?
A. Không màu.
B. Màu nâu đỏ.
C. Không hòa tan trong nước.
D. Có mùi khai.
Câu 11: Phương trình hóa học nào sau đây đúng?
A.
B.
C.
D.
Câu 12: Hoàn thành sơ đồ chuyển hóa sau:
Câu 13: Viết phương trình hoá học thực hiện dãy chuyển hoá sau:
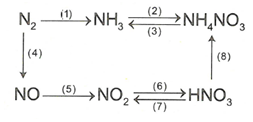
Dạng 2: Cân bằng phản ứng oxi hóa – khử của những phản ứng có sự tham gia của hoặc theo phương pháp thăng bằng ion – electron.
Ví dụ mẫu
Ví dụ 1: Hoàn thành phương trình phản ứng sau theo phương pháp ion-electron:
Hướng dẫn giải
Bước 1: Xác định số oxi hóa của các nguyên tố để tìm chất oxi hóa và chất khử:
Số oxi hóa của Cu tăng từ 0 lên +2 Cu là chất khử.
Số oxi hóa của giảm từ +5 xuống +2 Chất oxi hóa:
Bước 2: Viết quá trình oxi hóa - khử và cân bằng mỗi quá trình:
Bước 3: Cân bằng phương trình.
Phương trình ion rút gọn:
Phương trình phân tử:
|
Chú ý: NO3- thể hiện tính oxi hóa trong môi trường axit. |
IV. Bài tập tự luyện dạng 2
Bài tập cơ bản
Câu 1: Cho phương trình hóa học: . Tỉ lệ a : b là
A. 1 : 3. B. 2 : 3.
C. 2 : 5. D. 1 : 4.
Câu 2: Cho phản ứng: . Hệ số của HNO3 là
A. 8. B. 9.
C. 10. D. 11.
Bài tập nâng cao
Câu 3: Cho phản ứng: . Biết khi cân bằng tỉ lệ mol giữa NO và là 1 : 2. Với hệ số các chất trong phương trình là các số nguyên, tối giản. Hệ số của chất oxi hóa và chất khử trong phản ứng trên lần lượt là
A. 16 : 5. B. 5 : 16.
C. 7 : 10. D. 10 : 7.
Câu 4: Cho phản ứng: . Sau khi cân bằng phương trình hóa học trên (hệ số nguyên, tối giản) thì hệ số của là
A. B.
C. D. 18x - 6y
Dạng 3: Hỗn hợp các kim loại, oxit kim loại tác dụng với dung dịch
Phương pháp giải
Cách 1: Tính theo phương trình hóa học.
Cách 2: Áp dụng bảo toàn electron:
Chú ý: Khi cho nhiều kim loại tác dụng với cùng một dung dịch cần nhớ: Kim loại càng mạnh tác dụng với dung dịch càng loãng thì trong gốc bị khử xuống mức oxi hoá càng thấp hay .
Ví dụ: Cho 11 gam hỗn hợp Al và Fe vào dung dịch loãng, dư thì có 6,72 lít khí NO bay ra (đktc). Tính khối lượng mỗi kim loại trong hỗn hợp.
Hướng dẫn giải
Gọi x, y lần lượt là số mol Al và Fe trong hỗn hợp.
Khối lượng hỗn hợp là 11 gam nên:
Phương trình hóa học:
Theo phương trình:
Quá trình cho – nhận electron:
Bảo toàn electron:
hay
Từ (1) và (2) suy ra: x = 0,2 và y = 0,1
Khối lượng mỗi kim loại trong hỗn hợp bằng:
Ví dụ mẫu
Ví dụ 1: Hòa tan hoàn toàn 2,32 gam hỗn hợp FeO và vào dung dịch đặc, dư thì thu được 0,224 lít khí (đktc). Tính khối lượng muối tạo thành sau phản ứng.
Hướng dẫn giải
Trong hỗn hợp chỉ có FeO phản ứng tạo thành chất khí.
Phương trình hóa học:
Ta có:
Phương trình hóa học:
Khối lượng muối thu được bằng:
|
Chú ý: thể hiện tính oxi hóa trong môi trường axit. |
V. Bài tập tự luyện dạng 3
Bài tập cơ bản
Câu 1: Hoà tan hoàn toàn m gam Fe vào dung dịch loãng thì thu được 0,448 lít khí NO duy nhất (đktc). Giá trị của m là
A. 5,60. B. 11,20.
C. 0,56. D. 1,12.
Câu 2: Khi cho 3 gam hỗn hợp Cu và Al tác dụng với đặc, dư, đun nóng sinh ra 4,48 lít khí ở đktc (sản phẩm khử duy nhất). Phần trăm khối lượng kim loại Cu trong hỗn hợp là
A. 55,7%. B. 45,5%.
C. 56,0%. D. 47,0%.
Bài tập nâng cao
Câu 3: Cho 60 gam hỗn hợp Cu và CuO tan hết trong 3 lít dung dịch 1M, thu được 13,44 lít khí NO (ở đktc). Tính phần trăm khối lượng của Cu trong hỗn hợp và nồng độ mol của axit trong dung dịch thu được (coi thể tích không đổi trong quá trình phản ứng).
ĐÁP ÁN
Dạng 1: Câu hỏi lí thuyết
|
1 – B |
2 – B |
3 – C |
4 – A |
5 – A |
6 – D |
7 – C |
8 – D |
9 – C |
10 – B |
|
11 – B |
|
|
|
|
|
|
|
|
|
Câu 12: Phương trình hóa học:
hay
Câu 13: Phương trình hóa học:
Dạng 2: Cân bằng phản ứng oxi hóa – khử của những phản ứng có sự tham gia của hoặc theo phương pháp thăng bằng ion – electron.
|
1 – D |
2 – C |
3 – A |
4 – D |
Dạng 3: Hỗn hợp các kim loại, oxit kim loại tác dụng với dung dịch
Câu 1: Chọn D.
Câu 2: Chọn A.
Câu 3:
Ta có:
Phương trình hóa học:
Theo phương trình (1):
Phần trăm khối lượng Cu trong hỗn hợp ban đầu bằng:
Ta có:
Theo phương trình (2):
Tổng số mol phản ứng là:
Số mol dư bằng:
Nồng độ axit dư trong dung dịch sau phản ứng bằng:









