Với tóm tắt lý thuyết Hóa học lớp 8 Điều chế khí oxi - Phản ứng phân hủy hay, chi tiết cùng với 21 câu hỏi trắc nghiệm chọn lọc có đáp án giúp học sinh nắm vững kiến thức trọng tâm, ôn luyện để học tốt môn Hóa học lớp 8.
Hóa học 8 Bài 27: Điều chế khí oxi - Phản ứng phân hủy
A. Lý thuyết Điều chế khí oxi - Phản ứng phân hủy
1. Điều chế oxi
a. Trong phòng thí nghiệm
Đun nóng hợp chất giâu oxi và dễ bị phân hủy ở nhiệt độ cao như kali pemanganat KMnO4 hoặc kali clorat KClO3 trong ống nghiệm, oxi thoát ra theo PT:
2KMnO4 −to→ K2MnO4 + MnO2 + O2
2KClO3 −to→ 2KCl + 3O2
b. Trong công nghiệp
- Sản xuất từ không khí: hóa lỏng không khí ở nhiệt độ thấp và áp suất cao. Trước hết thu được Nitơ (- 196°C ) sau đó là Oxi ( - 183°C)
- Sản xuất từ nước: điện phân nước
2. Phản ứng phân hủy
Là phản ứng hóa học trong đó từ môtj chất sinh ra nhiều chất mới.
VD: 2KMnO4 −to→ K2MnO4 + MnO2 + O2
2KClO3 −to→ 2KCl + 3O2
B. Trắc nghiệm Điều chế khí oxi - Phản ứng phân hủy
Câu 1: Người ta thu khí oxi bằng cách đẩy nước nhờ dựa vào tính chất:
A. Khí oxi tan trong nước
B. Khí oxi ít tan trong nước
C. Khí oxi khó hóa lỏng
D. Khí oxi nhẹ hơn nước
Lời giải:
Người ta thu khí oxi bằng cách đẩy nước nhờ dựa vào tính chất: Khí oxi ít tan trong nước
Đáp án cần chọn là: B
Câu 2: Người ta thu khí oxi bằng cách đẩy không khí nhờ dựa vào tính chất:
A. khí oxi nhẹ hơn không khí
B. khí oxi nặng hơn không khí
C. khí oxi dễ trộn lẫn với không khí
D. khí oxi ít tan trong nước
Lời giải:
Người ta thu khí oxi bằng cách đẩy không khí nhờ dựa vào tính chất: khí oxi nặng hơn không khí
Đáp án cần chọn là: B
Câu 3: Chọn định nghĩa phản ứng phân hủy đầy đủ nhất:A. Phản ứng phân hủy là phản ứng hóa học trong đó một chất sinh ra một chất mới
B. Phản ứng phân hủy là phản ứng hóa học trong đó một chất sinh ra hai chất mới
C. Phản ứng phân hủy là phản ứng hóa học trong đó một chất sinh ra hai hay nhiều chất mới
D. Phản ứng phân hủy là phản ứng hóa học có chất khí thoát ra
Lời giải:
Phản ứng phân hủy là phản ứng hóa học trong đó một chất phản ứng sinh ra hai hay nhiều chất mới
Đáp án cần chọn là: C
Câu 4: Cho các phản ứng sau:
1) 2FeCl2 + Cl2 → 2FeCl3
2) CuO + H2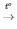 Cu + H2O
Cu + H2O
3) 2KNO3 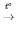 2KNO2 + O2
2KNO2 + O2
4) 2Fe(OH)3 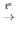 Fe2O3 + 3H2O
Fe2O3 + 3H2O
5) CH4 + 2O2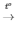 CO2 + 2H2O
CO2 + 2H2O
Số phản ứng phân hủy là
A. 1.
B. 2.
C. 3.
D. 4.
Lời giải:
Phản ứng phân hủy là phản ứng hóa học trong đó một chất phản ứng sinh ra hai hay nhiều chất mới
=> Số phản ứng phân hủy là
3) 2KNO3 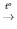 2KNO2 + O2
2KNO2 + O2
4) 2Fe(OH)3 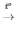 Fe2O3 + 3H2O
Fe2O3 + 3H2O
Đáp án cần chọn là: B
Câu 5: Nguyên liệu để sản xuất O2 trong công nghiệp là phương án nào sau đây:
A. KMnO4
B. KClO3
C. KNO3
D. Không khí
Lời giải:
Nguyên liệu để sản xuất O2 trong công nghiệp là: không khí
Sản xuất khí oxi từ không khí bằng cách hạ không khí xuống dưới -200oC, sau đó nâng dần nhiệt độ lên -196oC ta thu được khí N2, sau đó nâng đến -183oC ta thu được khí oxi.
Đáp án cần chọn là: D
Câu 6: Cho các chất sau: FeO (1), KClO3 (2), KMnO4 (3), CaCO3 (4), không khí (5), H2O (6). Những chất nào được dùng để điều chế oxi trong phòng thí nghiệm?
A. 2, 3
B. 2, 3, 5, 6
C. 1, 2, 3,5
D. 2, 3, 5
Lời giải:
Trong PTN, khí oxi được điều chế bằng cách đun nóng những hợp chất giàu oxi và dễ bị phân huỷ ở nhiệt độ cao như KMnO4 và KClO3
=> 2 chất dùng để điều chế oxi trong phòng thí ngiệm là: KClO3 (2), KMnO4 (3)
Đáp án cần chọn là: A
Câu 7: Cho các phản ứng hóa học sau:
1) 2H2 + O2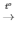 2H2O
2H2O
2) CuO + H2 → Cu + H2O
3) 2KNO3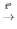 2KNO2 + O2
2KNO2 + O2
4) 4P + 5O2 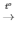 2P2O5
2P2O5
5) 2Fe(OH)3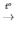 Fe2O3 + 3H2O
Fe2O3 + 3H2O
6) Fe + 2HCl → FeCl2 + H2
7) CaO + CO2 → CaCO3
Số phản ứng phân hủy và số phản ứng hóa hợp lần lượt là
A. 3; 2.
B. 2; 3.
C. 4; 1.
D. 2; 4.
Lời giải:
+) Phản ứng phân hủy: 1 chất → 2 hay nhiều chất
=> các phản ứng phân hủy là
3) 2KNO3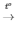 2KNO2 + O2
2KNO2 + O2
5) 2Fe(OH)3 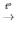 Fe2O3+ 3H2O
Fe2O3+ 3H2O
+) Phản ứng hóa hợp: 2 hay nhiều chất → 1 chất
1) 2H2 + O2 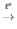 2H2O
2H2O
4) 4P + 5O2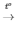 2P2O5
2P2O5
7) CaO + CO2 → CaCO3
Vậy có 2 phản ứng phân hủy và 3 phản ứng hóa hợp
Đáp án cần chọn là: B
Câu 8: Nhiệt phân cùng một lượng số mol mỗi chất sau: KMnO4; KClO3; KNO3; H2O2. Chất nào thu được lượng khí oxi lớn nhất?
A. KMnO4
B. KClO3
C.KNO3
D. H2O2
Lời giải:
Giả sử lấy 1 mol mỗi chất
Phương trình hóa học nhiệt phân:
2KMnO4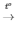 K2MnO4 + MnO2 + O2
K2MnO4 + MnO2 + O2
Tỉ lệ PT: 2mol 1mol
P/ứng: 1mol → 0,5mol
2KClO3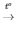 2KCl + 3O2
2KCl + 3O2
Tỉ lệ PT: 2mol 3mol
P/ứng: 1mol → 1,5mol
2KNO3 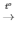 2KNO2 + O2
2KNO2 + O2
Tỉ lệ PT: 2mol 1mol
P/ứng: 1mol → 0,5mol
2H2O2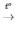 2H2O + O2
2H2O + O2
Tỉ lệ PT: 2mol 1mol
P/ứng: 1mol → 0,5mol
=> chất thu được lượng khí oxi lớn nhất là KClO3
Đáp án cần chọn là: B
Câu 9: Lấy các mẫu chất sau có cùng khối lượng: KMnO4; KClO3; KNO3; H2O2. Chất nào điều chế được lượng khí oxi lớn nhất?A. KMnO4.
B. KClO3
C. KNO3
D. H2O2
Lời giải:
Giả sử lấy 100 gam mỗi chất
=>nKMnO4= 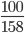 ≈0,633mol;nKClO3=
≈0,633mol;nKClO3= 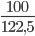 ≈ 0,816 mol
≈ 0,816 mol
nKNO3= 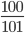 = 0,99mol;nH2O2=
= 0,99mol;nH2O2=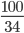 =2,94mol
=2,94mol
Phương trình hóa học nhiệt phân:
2KMnO4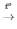 K2MnO4 + MnO2 + O2
K2MnO4 + MnO2 + O2
Tỉ lệ PT: 2mol 1mol
P/ứng: 0,633mol → 0,3165mol
2KClO3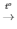 2KCl + 3O2
2KCl + 3O2
Tỉ lệ PT: 2mol 3mol
P/ứng: 0,816mol → 1,224mol
2KNO3 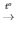 2KNO2 + O2
2KNO2 + O2
Tỉ lệ PT: 2mol 1mol
P/ứng: 0,99mol → 0,495mol
2H2O2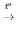 2H2O + O2
2H2O + O2
Tỉ lệ PT: 2mol 1mol
P/ứng: 2,94mol → 1,47mol
=> chất thu được lượng khí oxi lớn nhất là H2O2
Đáp án cần chọn là: D
Câu 10: Trong phòng thí nghiệm cần điều chế 4,48 lít O2 (đktc). Dùng chất nào sau đây để có khối lượng nhỏ nhất:
A. KClO3
B. KMnO4
C. KNO3
D. H2O2
Lời giải:
Số mol O2 thu được là: nO2 = 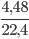 = 0,2 mol
= 0,2 mol
Phương trình hóa học:
2KMnO4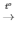 K2MnO4 + MnO2 + O2
K2MnO4 + MnO2 + O2
Tỉ lệ PT: 2mol 1mol
P/ứng: 0,4mol ← 0,2mol
=> mKMnO4=0,4.158=63,2 gam
2KClO3 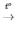 2KCl + 3O2
2KCl + 3O2
Tỉ lệ PT: 2mol 3mol
P/ứng: 0,133mol ← 0,2mol
=> mKClO3=0,133.122,5=16,29 gam
2KNO3 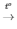 2KNO2 + O2
2KNO2 + O2
Tỉ lệ PT: 2mol 1mol
P/ứng: 0,4mol ← 0,2mol
=> mKNO3=0,4.101=40,4 gam
2H2O2 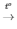 2H2O + O2
2H2O + O2
Tỉ lệ PT: 2mol 1mol
P/ứng: 0,4mol ← 0,2mol
=> mH2O2=0,4.34=13,6 gam
=> chất có khối lượng nhỏ nhất là H2O2
Đáp án cần chọn là: D
Câu 11: Thí nghiệm nung nóng mạnh Thuốc tím trong ống nghiệm sau đó đưa tàn đỏ que diêm vào miệng ống nghiệm có hiện tượng:
A. Tàn đỏ tắt.
B. Tàn đỏ nổ to.
C. Tàn đỏ giữ nguyên.
D. Tàn đỏ bùng sáng.
Lời giải:
2KMnO4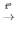 K2MnO4 + O2↑
K2MnO4 + O2↑
Do phản ứng nhiệt phân sinh ra khí O2 vì vậy khi đưa tàn đóm đỏ que diêm vào miệng ống nghiệm có hiện tượng tàn đóm bùng sáng.
Đáp án cần chọn là: D
Câu 12: Phản ứng phân hủy là
A. Ba + 2HCl → BaCl2 + H2
B. Cu + H2S → CuS+H2
C. MgCO3 → MgO + CO2
D. KMnO4 → MnO + O2 + K2O
Đáp án: C
Câu 13: Cho phản ứng 2KMnO4 −to→ K2MnO4 + MnO2 + O2
Tổng hệ số sản phẩm là
A. 3
B. 2
C. 1
D. 5
Đáp án: A
Câu 14: Tính khối lượng KMnO4 biết nhiệt phân thấy 2,7552 l khí bay lên
A. 38,678 g
B. 38,868 g
C. 37,689 g
D. 38,886 g
Đáp án: B
nKMnO4= 0,246.158 = 38,868 g
Câu 15: Phương trình không điều chế oxi trong phòng thí nghiệm
A. 2KMnO4 −to→ K2MnO4 + MnO2 + O2 ↑
B. 2H2O2 −to→ 2H2O + O2
C. 2KClO3 −MnO2→ 2KCl + 3O2
D. 2H2O −to→ 2H2 + O2
Đáp án: D
Câu 16: Các chất dung để điều chế Oxi trong phòng thí nghiệm là
A. KClO3
B. KMnO4
C. CaCO3
D. Cả A & B
Đáp án: D
Câu 17: Tổng hệ số của chất tham gia và sản phẩm là
2KClO3 −to→ 2KCl + 3O2
A. 2&5
B. 5&2
C. 2&2
D. 2&3
Đáp án: A
Câu 18: Có những cách nào điều chế oxi trong công nghiệp
A. Dùng nghiên liệu là không khí
B. Dùng nước làm nguyên liệu
C. Cách nào cũng được
D. A&B
Đáp án: D
Câu 19: Nhiệt phân 12,25 g KClO3 thấy có khí bay lên. Tính thể tích của khí ở đktc
A. 4,8 l
B. 3,36 l
C. 2,24 l
D. 3,2 l
Đáp án: B
VO2= 0,15.22,4 = 3,36 l
Câu 20: Số sản phẩm tạo thành của phản ứng phân hủy là
A. 2
B. 3
C. 2 hay nhiều sản phẩm
D. 1
Đáp án: C
Câu 21: Chọn nhận xét đúng
A. Phản ứng phân hủy là một dạng của phản ứng hóa học
B. Phản ứng hóa hợp là phản ứng oxi hóa khử
C. Phản ứng phân hủy là phản ứng sinh ra duy nhất 2 chất mới
D. Cả A và C đều đúng
Đáp án: A