Tailieumoi.vn giới thiệu Giải bài tập hóa học 8 Bài 27: Điều chế oxi - Phản ứng phân hủy, chi tiết nhất giúp học sinh dễ dàng làm bài tập Điều chế oxi - Phản ứng phân hủy lớp 8.
a) Fe3O4 ; b) KClO3 ; c) KMnO4 ; d) CaCO3 ; e) Không khí ; g) H2O.
Lời giải:Những chất được dùng để điều chế oxi trong phòng thí nghiệm:
(b) KClO3 và (c) KMnO4.
PTHH:
|
Phòng thí nghiệm |
Công nghiệp |
|
|
Nguyên liệu |
KMnO4, KClO3 |
không khí, nước |
|
Sản lượng |
đủ để làm thí nghiệm |
sản lượng lớn |
|
Giá thành |
cao |
thấp |
Cách điều chế trong CN và PTN cũng khác nhau, trong PTN nhiệt phân KMnO4, KClO3 còn trong CN là hóa lỏng không khí hoặc điện phân nước
|
|
Phản ứng hóa hợp |
Phản ứng phân hủy |
|
Chất tham gia |
Hai hay nhiều chất |
Một chất |
|
Chất tạo thành |
Một chất |
Hai hay nhiều chất. |
|
Ví dụ |
S + O2 SO2 2Ca + O2 2CaO |
CaCO3 CaO + CO2 2HgO 2Hg + O2 |
a) 48 g khí oxi ;
b) 44,8 lít khí oxi (đktc).
Lời giải:Phương trình phản ứng hóa học :
2KClO3 2KCl + 3O2
2 mol 3 mol
mol 1 mol
a. Số mol oxi tạo thành: (mol).
Theo phương trình phản ứng hóa học ta có:
(mol).
Khối lượng kali clorat cần thiết là :
= n.M = 1.(39 + 35,5 + 48) = 122,5 (g).
b) Số mol khí oxi tạo thành : = 2(mol).
Theo phương trình phản ứng hóa học ta có:
≈ 1,333 (mol).
Khối lượng kali clorat cần thiết là :
a) Viết phương trình hóa học của phản ứng.
b) Phản ứng nung vôi thuộc loại phản ứng hóa học nào ? Vì sao ?
Lời giải:a) CaCO3 CaO + CO2
b) Phản ứng nung vôi thuộc phản ứng phân hủy. Vì dưới tác động của nhiệt độ, từ một chất (đá vôi) bị phân hủy thành hai chất (vôi sống và khí cacbonic).
a. Tính số gam sắt và oxi cần dùng để điều chế được 2,32g oxit sắt từ ?
b. Tính số gam kali penmanganat KMnO4 cần dùng để có được lượng oxi dùng cho phản ứng trên, biết rằng khi nung nóng 2 mol KMnO4 thì thu được 1 mol O2.
Lời giải:a. Số mol oxit sắt từ : = 0,01 (mol).
Phương trình hóa học.
3Fe + 2O2 Fe3O4
3mol 2mol 1mol.
0,03 mol 0,02 mol 0,01 mol.
Khối lượng sắt cần dùng là:
Khối lượng oxi cần dùng là :
b. Phương trình hóa học :
2KMnO4 K2MnO4 + MnO2 + O2
2mol 1mol
0,04 mol 0,02 mol
Số gam penmanganat cần dùng là :
m = 0,04. (39 + 55 + 16.4) = 6,32 g.
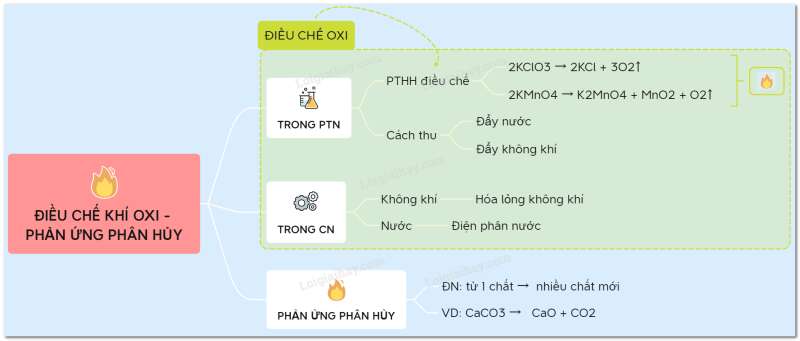
1. Điều chế oxi
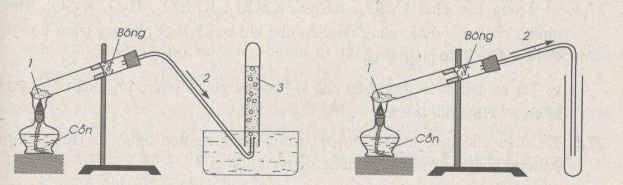
a. Trong phòng thí nghiệm
Trong PTN, khí oxi được điều chế bằng cách đun nóng những hợp chất giàu oxi và dễ bị phân huỷ ở nhiệt độ cao như KMnO4 và KClO3
2KMnO4 K2MnO4 + MnO2 + O2
2KClO3 2KCl + 3O2
2KNO3 2KNO2 + O2
* Cách thu khí oxi:
- Vì khí oxi ít tan trong nước => thu khí oxi bằng cách đẩy nước
- Khí oxi có => oxi nặng hơn không khí => thu khí oxi bằng cách đẩy không khí
b. Trong công nghiệp
- Bằng cách hạ không khí xuống dưới -200oC, sau đó nâng dần nhiệt độ lên -196oC ta thu được khí N2, sau đó nâng đến -183oC ta thu được khí oxi.
- Sản xuất từ nước: điện phân nước
2H2O 2H2 ↑ + O2
2. Phản ứng phân hủy
* Định nghĩa: Phản ứng phân huỷ là phản ứng hoá học trong đó một chất phản ứng sinh ra hai hay nhiều chất mới.
Ví dụ:
2KMnO4 K2MnO4 + MnO2 + O2
2KClO3 2KCl + 3O2
2H2O 2H2 + O2
CaCO3 CaO + CO2
Sơ đồ tư duy: Điều chế khí oxi - phản ứng phân hủy