Với tóm tắt lý thuyết Hóa học lớp 8 Tính chất của oxi hay, chi tiết cùng với 25 câu hỏi trắc nghiệm chọn lọc có đáp án giúp học sinh nắm vững kiến thức trọng tâm, ôn luyện để học tốt môn Hóa học lớp 8.
Hóa học 8 Bài 24: Tính chất của oxi
A. Lý thuyết Tính chất của oxi
- Kí hiệu hóa học : O
- CTHH : O2
- Nguyên tử khối: 16. Phân tử khối: 32
1. Tính chất vật lí
- Là chất khí không màu, không mùi, ít tan trong nước, nặng hơn không khí
- Oxi hóa lỏng ở -183°C
- Oxi lỏng có màu xanh nhạt
2. Tính chất hóa học
a. Tác dụng với phi kim
- Với lưu huỳnh
- Lưu huỳnh cháy trong không khí với ngọn lửa nhỏ, màu xanh nhạt; cháy trong khí oxi manh liệt hơn, tạo thành khí lưu huỳnh dioxit SO2 (còn gọi là khí sunfuro) và rất ít lưu huỳnh trioxit SO3
- PTHH:
S + O2 −to→ SO2
Với photpho:
Photpho cháy mạnh trong oxi với ngọn lửa sáng chói, tạo khói trắng dày đặc bám vào thành lọ dưới dạng bột tan được trong nước. Bột trắng đó là điphotpho pentaoxit có CTHH là P2O5.
PTHH:
4P + 5O2 −to→ 2P2O5
⇒ Vậy oxi có thể tác dụng với phi kim khi ở nhiệt độ cao. Trong hợp chất oxi hóa trị II
b. Tác dụng với kim loại
Cho dây sắt cuốn một mẩu than hồng vào lọ khí oxi, mẩu than cháy trước tạo nhiệt độ đủ cao cho sắt cháy. Sắt cháy mạnh, sáng chói, không có ngọn lửa, không có khói, tạo ra các hạt nhỏ nóng chảy màu nâu là sắt (II, III) oxit, công thức hóa học là Fe3O4, thường được gọi là oxit sắt từ
PTHH:
3Fe + 2O2 −to→ Fe3O4
c. Tác dụng với hợp chất:
Khí metan (có trong khí bùn, ao, bioga) cháy trong không khí do tác dụng với oxi, tỏa nhiều nhiệt
CH4 + 2O2 −to→ CO2 + 2H2O
⇒ Oxi có thể tác dụng với kim loại, phi kim và các hợp chất ở nhiệt độ cao. Trong các hợp chất hóa học oxi hóa trị II.
B. Trắc nghiệm Tính chất của oxi
Câu 1: Trong các câu sau, câu nào sai?
A. Oxi nặng hơn không khí.
B. Oxi là chất khí không màu, không mùi, không vị.
C. Oxi tan nhiều trong nước.
D. Oxi chiếm 1/5 thể tích không khí.
Lời giải:
Câu sai là: Oxi tan nhiều trong nước.
Oxi là chất khí ít tan trong nước.
Đáp án cần chọn là: C
Câu 2: Chất rắn màu vàng cháy trong bình đựng khí oxi với ngọn lửa sáng xanh, có khí không màu, mùi hắc bay ra là hiện tượng của phản ứng:
A. S + O2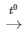 SO2
SO2
B. 4P + 5O2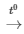 2P2O5
2P2O5
C. C + O2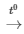 CO2
CO2
D. 3Fe + 2O2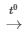 Fe3O4
Fe3O4
Lời giải:
Chất rắn màu vàng là S, S cháy trong bình đựng khí oxi với ngọn lửa sáng xanh, có khí không màu, mùi hắc bay ra là hiện tượng của phản ứng: S + O2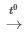 SO2
SO2
Đáp án cần chọn là: A
Câu 3: Cần bao nhiêu gam oxi để đốt cháy hết 2 mol lưu huỳnh?
A. 16 gam.
B. 32 gam.
C. 64 gam.
D. 48 gam.
Lời giải:
PTHH: S + O2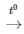 SO2
SO2
Tỉ lệ PT: 1mol 1mol
Phản ứng: 2mol → 2mol
=> Khối lượng oxi cần dùng là: mO2=n.M=2.32=64gammO2=n.M=2.32=64gam
Đáp án cần chọn là: C
Câu 4: Chất nào sau đây cháy mạnh trong khí oxi, sáng chói, tạo ra các hạt nóng chảy màu nâu?
A. Fe.
B. CH4.
C. P.
D. H2.
Lời giải:
Fe cháy mạnh trong khí oxi, sáng chói, tạo ra các hạt nóng chảy màu nâu là Fe3O4
PTHH: 3Fe + 2O2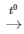 Fe3O4
Fe3O4
Đáp án cần chọn là: A
Câu 5: Khi đốt cháy mẫu dây sắt trong bình đựng khí oxi, dây sắt cháy mạnh, sáng chói, tạo ra:
A. Các hạt nhỏ nóng chảy màu nâu đỏ là sắt (III) oxit.
B. Các hạt nhỏ nóng chảy màu đỏ là oxit sắt từ.
C. Các hạt nhỏ nóng chảy màu xám là sắt (III) oxit.
D. Các hạt nhỏ nóng chảy màu nâu đen là sắt từ oxit.
Lời giải:
3Fe + 2O2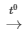 Fe3O4 (oxit sắt từ)
Fe3O4 (oxit sắt từ)
Đáp án cần chọn là: B
Câu 6: Người ta điều chế oxi trong phòng thí nghiệm bằng cách nào sau đây?
A. Chưng cất phân đoạn không khí lỏng.
B. Điện phân nước.
C. Điện phân dung dịch NaOH.
D. Nhiệt phân KClO3 với xúc tác MnO2.
Lời giải:
- O2 điều chế bằng phản ứng phân hủy những hợp chất giàu oxi và không bền nhiệt như KMnO4, KClO3, H2O2,…
2KMnO4 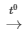 K2MnO4 + MnO2 + O2
K2MnO4 + MnO2 + O2
2KClO3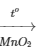 2KCl + 3O2
2KCl + 3O2
Đáp án cần chọn là: D
Câu 7: Chất nào sau đây dùng để điều chế khí oxi trong công nghiệp?
A. CaCO3.
B. H2O.
C. KMnO4.
D. KClO3
Lời giải:
Điều chế khí oxi trong công nghiệp, người ta điện phân nước: 2H2O → 2H2 + O2
Đáp án cần chọn là: B
Câu 8: Đốt cháy 6,2 gam P trong bình chứa 6,72 lít khí oxi (đktc) tạo thành P2O5.
a, Chất nào còn dư,chất nào hết?
A. P còn dư, O2 phản ứng hết.
B. P hết, O2 dư.
C. Cả 2 chất vừa đủ.
D. Tất cả đều sai.
Lời giải:
Số mol của Photpho là: 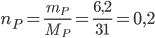
Số mol oxi là: 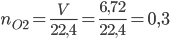
Phương trình phản ứng: 4P + 5O2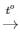 2P2O5
2P2O5
Xét tỉ lệ phản ứng số mol chia cho hệ số phản ứng, ta có: 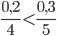
=> oxi dư, P phản ứng hết => phản ứng tính theo O
Đáp án cần chọn là: B
b, Khối lượng chất tạo thành là bao nhiêu
A. 15,4 gam.
B. 16 gam.
C. 14,2 gam.
D. 13,3 gam.
Lời giải:
Khối lượng chất tạo thành ta dựa vào số mol của Photpho, là chất phản ứng vừa đủ
4P + 5O2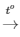 2P2O5
2P2O5
4mol 2mol
0,2mol ?mol
Số mol P2O5 tạo thành là: nP2O5= 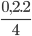 =0,1mol
=0,1mol
Khối lượng P2O5 tạo thành là: mP2O5=nP2O5.MP2O5=0,1.(31.2+16.5)=14,2gam
Đáp án cần chọn là: C
Câu 9: Tính số gam kali clorat cầm thiết để điều chế được 48 gam khí oxi?
A. 183,75 gam
B. 122,5 gam
C. 147 gam
D. 196 gam.
Lời giải:
Số mol khí oxi thu được là: nO2 = 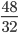 = 1,5 mol
= 1,5 mol
PTHH: 2KClO3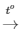 2KCl + 3O2
2KCl + 3O2
Tỉ lệ theo PT: 2mol 3mol
Phản ứng: 1mol ← 1,5mol
=> Khối lượng KClO3 cần dùng là: mKClO3=n.M=1.(39+35,5+16.3)=122,5gam
Đáp án cần chọn là: B
Câu 10: Đốt cháy hoàn toàn 24 kg than đá có chứa 0,5% tạp chất lưu huỳnh và 1,5% tạp chất khác không cháy được. Tính thể tích khí CO2 và SO2 tạo thành (ở điều kiện tiêu chuẩn)
A. 43904 lít.
B. 49388 lít.
C. 43988 lít.
D. 44904 lít
Lời giải:
Trong than đá chứa: Cacbon (x%), lưu huỳnh (0,5%) và tạp chất khác (1,5%)
=> x = 100 – 0,5 – 1,5 = 98 (%)
=> trong 24 kg than đá chứa: 24.98% = 23,52 kg = 23520 gam cacbon; 24.0,5% = 0,12 kg = 120 gam lưu huỳnh; 24.1,5% = 0,36 kg = 360 gam tạp chất khác
=> số mol C là:nC = 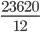 =1960mol
=1960mol
Số mol S là:nS = 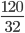 =3,75mol
=3,75mol
PTHH: C + O2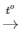 CO2
CO2
Tỉ lệ PT: 1mol 1mol
Phản ứng: 1960mol → 1960mol
=> Thể tích khí CO2 sinh ra là:VCO2=22,4.1960=43904
PTHH: S + O2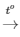 SO2
SO2
Tỉ lệ PT: 1mol 1mol
Phản ứng: 3,75mol → 3,75mol
=> Thể tích khí SO2 sinh ra là:VSO2=22,4.3,75=84 lít
=> tổng thể tích khí thu được là:V=VCO2+VSO2=43904+84=43988 lít
Đáp án cần chọn là: C
Câu 11: Đốt cháy m1 gam kẽm bằng khí oxi vừa đủ, thu được 12,15 gam ZnO. Hòa tan toàn bộ lượng ZnO ở trên vào dung dịch chứa m2 gam HCl vừa đủ thu được sản phẩm là ZnCl2 và nước. Tính m1 + m2
A. 20,7 gam.
B. 10,95 gam.
C. 9,75 gam.
D. 10,35 gam
Lời giải:
Số mol ZnO thu được là: nZnO = 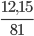 =0,15 mol
=0,15 mol
PTHH: 2Zn + O2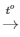 2ZnO
2ZnO
Tỉ lệ PT: 2mol 1mol 2mol
Phản ứng: 0,15mol ← 0,15mol
=> Khối lượng Zn phản ứng là: m1 = mZn = 0,15.65 = 9,75 gam
Lấy 0,15 mol ZnO cho vào dung dịch HCl
PTHH: ZnO + 2HCl → ZnCl2 + H2O
Tỉ lệ PT: 1mol 2mol
P/ứng: 0,15mol → 0,3mol
=> Khối lượng HCl phản ứng là: mHCl = m2 = 0,3.36,5 = 10,95 gam
=> m1 + m2 = 9,75 + 10,95 = 20,7 gam
Đáp án cần chọn là: A
Câu 12: Đốt cháy hoàn toàn 32 gam khí metan (CH4) cần V lít khí oxi (đktc), thu được khí CO2 và H2O. Giá trị của V là
A. 22,4 lít.
B. 89,6 lít.
C. 44,8 lít.
D. 67,2 lít.
Lời giải:
Số mol khí CH4 là: nCH4= 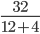 =2 mol
=2 mol
PTHH: CH4 + 2O2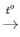 CO2 + 2H2O
CO2 + 2H2O
Tỉ lệ PT: 1mol 2mol
Phản ứng: 2mol → 4mol
=> thể tích khí oxi cần dùng là: VO2=22,4.n=22,4.4=89,6 lít
Đáp án cần chọn là: B
Câu 13: Đốt cháy hoàn toàn m1 gam khí etilen (C2H4) cần 7,392 lít khí oxi (đktc), thu được m2 gam khí CO2 và m3 gam H2O. Tính m1 + m2 + m3
A. 19,36 gam.
B. 10,59 gam.
C. 10,12 gam.
D. 16,72 gam.
Lời giải:
Số mol khí O2 là: nO2 = 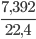 =0,33mol
=0,33mol
Ta có PTHH: C2H4 + 3O2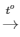 2CO2 + 2H2O
2CO2 + 2H2O
Theo phương trình cứ 3 mol O2 thì đốt cháy hết 1 mol C2H4
Theo đầu bài………………0,33 mol O2…... 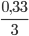 = 0,11mol C2H4
= 0,11mol C2H4
Áp dụng định luật bảo toàn khối lượng ta có: m C2H4 + mO2 = mCO2 + mH2O
=> mCO2 + mH2O = 0,11.28 + 0,33.32=13,64
=> m1 + m2 + m3 = m C2H4 + mCO2 + mH2O = 13,64 + 3,08= 16,72 gam
Đáp án cần chọn là: D
Câu 14: Đốt cháy 7,8 gam khí axetilen (C2H2) trong khí oxi, thu được 11,2 lít khí CO2 (đktc) và m2 gam H2O. Giá trị m2 là
Lời giải:
Số mol khí C2H2 là: nC2H2 = 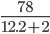 =0,3mol
=0,3mol
Số mol khí CO2 là: nCO2 = 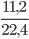 =0,5mol
=0,5mol
Vì đầu bài cho 2 số liệu số mol của chất phản ứng C2H2 và chất sản phẩm CO2 => tính toán theo chất sản phẩm
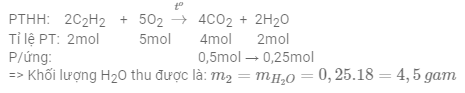
Đáp án cần chọn là: C
Câu 15: Khí được con người sử dụng để hô hấp là:
A. H2.
B. O2.
C. N2.
D. CO2.
Lời giải:
Con người hít khí O2 vào cơ thể để hô hấp
Đáp án cần chọn là: B
Câu 16: Cho 0,56 g Fe tác dụng với 16 g oxi tạo ra oxit sắt từ. Tính khối lượng oxit sắt từ và cho biết chất còn dư sau phản ứng
A. Oxi dư và m = 0,67 g
B. Fe dư và m = 0,774 g
C. Oxi dư và m = 0,773 g
D. Fe dư và m = 0,67 g
Đáp án: C
nFe = 0,56/56 = 0,01 mol, nO2 = 16/32 = 0,5 mol
Câu 17: Tính chất nào sau đây oxi không có
A. Oxi là chất khí
B. Trong các hợp chất, oxi có hóa trị 2
C. Tan nhiều trong nước
D. Nặng hơn không khí
Đáp án: C
Câu 18: Chọn đáp án đúng
A. Oxi không có khả năng kết hợp với chất hemoglobin trong máu
B. Khí oxi là một đơn chất kim loại rất hoạt động
C. Oxi nặng hơn không khí
D. Oxi có 3 hóa trị
Đáp án: C
Câu 19: Chọn đáp án đúng
A. CH4 + O2 → 2CO2 + H2O
B. 2C2H2 +5O2→ 4CO2 + 2H2O
C. Ba + O2 → BaO
D. 2KClO3 → 2KCl + O2
Đáp án: B
Câu 20: Tính thể tích khí oxi phản ứng khi đốt cháy 3,6 g C
A. 0,672 l
B. 67,2 l
C. 6,72 l
D. 0,0672 l
Đáp án: C
C + O2 → CO2
nC = 3,6/12 = 0,3 mol
nhìn vào phương trình thấy số mol của C bằng số mol oxi phản ứng
⇒ VO2 = 0,3.22,4 = 6,72 l
Câu 21: Khí oxi nặng hơn không khí bao nhiêu lần
A. 1,1 lần
B. 0,55 lần
C. 0,90625 lần
D. 1,8125 lần
Đáp án: A
Câu 22: Đốt cháy 3,1 g photpho trong bình chứa oxi tạo ra điphotpho pentaoxit. Tính khối lượng oxit thu được
A. 1,3945 g
B. 14,2 g
C. 1,42 g
D. 7,1 g
Đáp án: D
mP2O5= 0,05.142 = 7,1 g
Câu 23: Cháy mạnh, sáng chói, không có khói là hiện tượng của phản ứng
A. C+O2 → CO2
B. 3Fe+2O2 → Fe3O4
C. 2Cu+O2 → 2CuO
D. 2Zn+O2 → 2ZnO
Đáp án: B
Câu 24: Cháy trong oxi với lửa nhỏ có màu xanh nhạt, cháy trong không khí mãnh liệt hơn là hiện tượng của phản ứng
A. 2S + 3O2 → 2SO3
B. S + O2 → SO2
C. P + O2 → P2O5
D. P + O2 →P2O5
Đáp án: A
Câu 25: Cháy mạnh trong oxi với ngọn lửa sáng chói, tạo ra khói trắng dày đặc bám vào thành lọ dưới dạng bột hòa tan được nước là phản ứng
A. 4P + 5O2 → 2P2O5
B. P + O2 → P2O3
C. S + O2 →SO2
D. 2Zn + O2 →2 ZnO
Đáp án: A