Tailieumoi.vn giới thiệu Giải bài tập hóa học 8 Bài 24: Tính chất của oxi, chi tiết nhất giúp học sinh dễ dàng làm bài tập Tính chất của oxi lớp 8.
phi kim; kim loại; phi kim rất hoạt động; hợp chất; rất hoạt động
Oxi là một đơn chất………………….. Oxi có thể tham gia phản ứng hóa học với nhiều …………………….., ……………………….., …………………….
Lời giải:Ở nhiệt độ cao oxi tác dụng với hầu hết
+ Phi kim ( S, P...)
S + O2 SO2
+ Kim loại ( Fe, Mg...)
3Fe + 2O2 Fe3O4
+ Hợp chất ( CH4; C2H4...)
CH4 + 2O2 CO2 + 2H2O
2C4H10 + 13O2 8CO2 + 10H2O + Q
Vì phản ứng tỏa nhiệt (Q là nhiệt lượng, thể hiện phương trình tỏa nhiệt) => cộng thêm Q
a) Photpho hay oxi, chất nào còn thừa và số mol chất còn thừa là bao nhiêu ?
b) Chất nào được tạo thành, khối lượng là bao nhiêu ?
Lời giải:Số mol photpho: a (mol).
Số mol oxi : b (mol).
Phương trình phản ứng :
4P + 5O2 2P2O5
Theo PTHH ( mol) 4 5
Theo đề bài ( mol) a b
so sánh tỉ số
Tỉ số nào nhỏ hơn thì chất đó phản ứng hết. Mọi tính toán theo số mol của chất phản ứng hết.
a) Số mol photpho : 0,4 (mol).
Số mol oxi : 0,53 (mol).
Phương trình phản ứng :
4P + 5O2 2P2O5
Theo PTHH ( mol) 4 5
Theo đề bài ( mol) 0,4 0,53
Ta thấy < . Vậy P phản ứng hết, O2 dư. Mọi tính toán theo số mol của P
Theo PTHH:
b) Chất được tạo thành là P2O5 . Theo phương trình phản ứng, ta có :
0,2 (mol).
Khối lượng điphotpho pentaoxit tạo thành là : m = 0,2.(31.2 + 16.5) = 28,4 gam.
Bước 1: Tính thành phần phần trăm của C có trong than đá
% C = 100% - % S - % tạp chất không cháy = ?
Bước 2: Tính số gam của C, S
Bước 3: Viết PTHH xảy ra:
C + O2 CO2
S + O2 SO2
Bước 4: Tính toán số mol CO2; SO2 theo số mol của C, S
Phần trăm khối lượng cacbon có trong than đá là: % C = 100% - 0,5% - 1,5% = 98%
Khối lượng của cacbon là:
Khối lượng của lưu huỳnh là:
Phương trình hóa học các phản ứng xảy ra:
a. Oxi là khí duy trì sự sống của con người cũng như là động vật
- Khi nhốt một con dế mèn (hoặc một con châu chấu) vào một cái lọ nhỏ rồi đậy nút kín, thì sẽ không có oxi đi vào trong lọ
=> Con dế mèn (hoặc một con châu chấu) không đủ khí oxi để duy trì sự hô hấp
=> Một thời gian sau con vật sẽ chết
b. Cá cũng như bao loài động vật khác cần oxi cho quá trình hô hấp, mà trong bể cá thường thiếu oxi (vì oxi tan ít trong nước)
=> Do đó cần phải cung cấp thêm oxi cho cá bằng cách sục không khí vào bể.
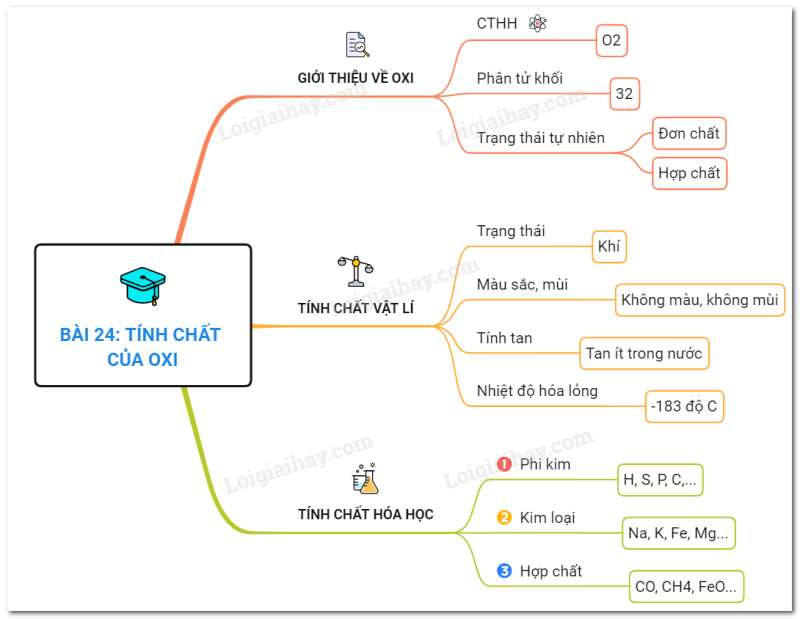
- Kí hiệu hóa học của nguyên tố oxi là O
- Công thức hóa học của đơn chất (khí) oxi là O2
- Nguyên tử khối: 16
- Phân tử khối: 32
I. Tính chất vật lí
- Là chất khí không màu, không mùi, ít tan trong nước, nặng hơn không khí
- Oxi hóa lỏng ở -183°C
- Oxi lỏng có màu xanh nhạt
II. Tính chất hóa học
1. Tác dụng với phi kim
- Với lưu huỳnh
+ Lưu huỳnh cháy trong không khí với ngọn lửa nhỏ, màu xanh nhạt; cháy trong khí oxi manh liệt hơn, tạo thành khí lưu huỳnh dioxit SO2 (còn gọi là khí sunfuro) và rất ít lưu huỳnh trioxit SO3
PTHH: S + O2 SO2
- Với photpho:
+ Photpho cháy mạnh trong oxi với ngọn lửa sáng chói, tạo khói trắng dày đặc bám vào thành lọ dưới dạng bột tan được trong không khí. Bột trắng đó là điphotpho pentaoxit có CTHH là P2O5
PTHH: 4P + 5O2 2P2O5
⇒ Vậy oxi có thể tác dụng với phi kim khi ở nhiệt độ cao. Trong hợp chất oxi hóa trị II
2. Tác dụng với kim loại
- Cho dây sắt cuốn một mẩu than hồng vào lọ khí oxi, mẩu than cháy trước tạo nhiệt độ đủ cao cho sắt cháy. Sắt cháy mạnh, sáng chói, không có ngọn lửa, không có khói, tạo ra các hạt nhỏ nóng chảy màu nâu là sắt (II, III) oxit, công thức hóa học là Fe3O4, thường được gọi là oxit sắt từ
PTHH: 3Fe + 2O2 Fe3O4
3. Tác dụng với hợp chất:
Khí metan (có trong khí bùn, ao, bioga) cháy trong không khí do tác dụng với oxi, tỏa nhiều nhiệt
PTHH: CH4 + 2O2 CO2 + 2H2O
⇒ Oxi có thể tác dụng với kim loại, phi kim và các hợp chất ở nhiệt độ cao. Trong các hợp chất hóa học oxi hóa trị II
Sơ đồ tư duy: Tính chất của oxi