Với tóm tắt lý thuyết Hóa học lớp 12 Điều chế kim loại hay, chi tiết cùng với 16 câu hỏi trắc nghiệm chọn lọc có đáp án giúp học sinh nắm vững kiến thức trọng tâm, ôn luyện để học tốt môn Hóa học lớp 12.
Hóa học 12 Bài 21: Điều chế kim loại
A. Lý thuyết Điều chế kim loại
Khử ion kim loại thành nguyên tử.
Mn+ + ne → M
1. Phương pháp thuỷ luyện
Nguyên tắc: Dùng những dung dịch thích hợp như: H2SO4, NaOH, NaCN, … để hoà tan kim loại hoặc các hợp chất của kim loại và tách ra khỏi phần không tan có ở trong quặng. Sau đó khử những ion kim loại này trong dung dịch bằng những kim loại có tính khử mạnh như Fe, Zn, …
Phạm vi áp dụng: Thường sử dụng để điều chế các kim loại có tính khử yếu.
Ví dụ:
Fe + CuSO4 → FeSO4 + Cu↓
Fe + Cu2+ → Fe2+ + Cu↓
2. Phương pháp nhiệt luyện
Nguyên tắc: Khử ion kim loại trong hợp chất ở nhiệt độ cao bằng các chất khử như C, CO, H2 hoặc các kim loại hoạt động.
Phạm vi áp dụng: Sản xuất các kim loại có tính khử trung bình (Zn, FE, Sn, Pb, …) trong công nghiệp.
Ví dụ:
3. Phương pháp điện phân
a. Điện phân hợp chất nóng chảy
Nguyên tắc: Khử các ion kim loại bằng dòng điện bằng cách điện phân nóng chảy hợp chất của kim loại.
Phạm vi áp dụng: Điều chế các kim loại hoạt động hoá học mạnh như K, Na, Ca, Mg, Al.
Ví dụ: Điện phân MgCl2 nóng chảy để điều chế Mg.
Phương trình điện phân:
b. Điện phân dung dịch
Nguyên tắc: Điện phân dung dịch muối của kim loại.
Phạm vi áp dụng: Điều chế các kim loại có độ hoạt động hoá học trung bình hoặc yếu.
Ví dụ: Điện phân dung dịch CuCl2 để điều chế kim loại Cu.
Phương trình điện phân:
Tính lượng chất thu được ở các điện cực
Dựa vào công thức Farađây: 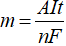
m: Khối lượng chất thu được ở điện cực (g).
A: Khối lượng mol nguyên tử của chất thu được ở điện cực.
n: Số electron mà nguyên tử hoặc ion đã cho hoặc nhận.
I: Cường độ dòng điện (ampe).
t: Thời gian điện phân (giấy).
F: Hằng số Farađây (F = 96.500).
B. Trắc nghiệm Điều chế kim loại
Bài 1: Cho các chất sau đây : NaOH, Na2CO3, NaCl, NaNO3 và Na2SO4. Có bao nhiêu chất điều chế được Na chỉ băng 1 phản ứng ?
A. 1 B. 2 C. 3 D.
Đáp án: B
Bài 2: Trộn 0,54 gam bột nhôm với hỗn hợp gồm bột Fe2O3 và CuO rồi tiến hành phản ứng nhiệt nhôm thu được hỗn hợp A. Hòa tan hoàn toàn A trong dung dịch HNO3 thu được hỗn hợp khí gồm NO và NO2 có tỉ lệ số mol tương ứng là 1 : 3. Thể tích khí NO (ở đktc) là
A. 0,224 lít; B. 0,672 lít. C. 0,075 lít. D. 0,025 lít.
Đáp án: A
Bài 3: Để điều chế Al kim loại ta có thể dùng phương pháp nào trong các phương pháp sau đây ?
A. Dùng Zn đẩy AlCl3 ra khỏi muối
B. Dùng CO khử Al2O3
C. Điện phân nóng chảy Al2O3
D. Điện phân dung dịch AlCl3
Đáp án: C
Bài 4: Cho khí CO (dư) đi qua ống sứ nung nóng đựng hỗn hợp X gồm: Al2O3, MgO, Fe3O4, CuO thu được chất rắn Y. Cho Y vào dung dịch NaOH (dư), khuấy kĩ, thấy còn lại phần không tan Z. Giả sử các phản ứng xảy ra hoàn toàn. Phần không tan Z gồm:
A. MgO, Fe, Cu.
B. Mg, Fe, Cu, Al.
C. MgO, Fe3O4, Cu, Al2O3.
D. Mg, FeO, Cu.
Đáp án: A
Bài 5: Trong quá trình điện phân dung dịch Pb(NO3)2 với các điện cực trơ, ion Pb2+ di chuyển về:
A. Catot và bị oxi hoá.
B. Anot và bị oxi hóa.
C. Catot và bị khử.
D. Anot và bị khử
Bài 6: Cho hơi nước qua than nóng đỏ thu được 2,24 lít hồn hợp khí X gồm CO2, CO và 112 (đo ở đktc). Dẫn X qua hổn hợp gồm CuO và Al2O3 dư nung nóng thu dược m gam chất rắn và hỗn hợp khí và hơi Y. Dẫn Y qua dung dịch Ca(OH)2 dư, lọc bỏ kết tủa thấy khối lượng dung dịch giảm 1,16 gam. Khối lượng kim loại có trong m là
A. 5,12 gam. B. 1,44 gam. C. 6,4 gam. D. 2,7 gam.
Đáp án: A
Phản ứng của than nóng đỏ với hơi nước:
Theo đề ta có: 3x + 2y = 0,1 (1)
Khi dẫn hỗn hợp khí X qua hỗn hợp gồm CuO và Al2O3 dư, chỉ có CuO phản ứng:
Khí và hơi Y thoát ra gồm: (x+y) mol CO2 và (2x+ y) mol H2O
Dẫn Y qua dung dịch Ca(OH)2 dư, sẽ có phản ứng:
Trong phần nước lọc, khối lượng giảm 1,16 gam
⇒ 100.(x + y) – 44(x + y) – 18(2x + y) = 1,16 (2)
Giải hệ (1) và (2) ⇒ x = y = 0,02 mol
Số mol kim loại Cu tạo ra là: 2x + 2y =0,08 mol
Khối lượng kim loại có trong m là 5,12 gam
Bài 7: Điện phân 1 lit dung dịch có chứa 18,8 gam Cu(NO3)2 và 29,8 gam KCl bằng điện cực trơ, có màng ngăn xốp. Sau 1 thời gian thấy khối lượng dung dịch giảm 34,3 gam so với ban đầu. Coi thẻ tích dung dịch không đổi trong quá trình điện phân, Nồng độ các chất trong dung dịch sau khi điện phân là
A. KCl 0,1M; KNO3 0,2M ; KOH 0,1M,
B. KNO3 0,1 M ; KCl 0,2 M
C. KCl 0,05M ; KNO3 0,2M ; KOH 0,15M.
D. KNO3 0,2M , KOH 0,2M.
Đáp án: D
Số mol Cu(NO3)2 và KCl lần lượt là 0,1 và 0,4 mol
Tại catot lần lượt xảy ra các quá trình: (1) Cu2+ +2e → Cu
(2) 2H2O + 2e → H2 + 2OH-
Tại anot lần lượt xảy ra các quá trình: (a) 2Cl- →Cl2 + 2e
(b) 2H2O → 4H+ + O2 + 4e
Nhận xét: trong số các ion do muối điện li ra chỉ có Cu2+ và Cl- bị điện phân ở các điện cực.
Nếu Cu2+ và Cl- bị điện phân hết, tổng khối lượng dung dịch giảm:
(0,1.64 + 0,4.35,5) = 20,6 (gam) < 34,3 gam
⇒ Cu2+ và Cl- bị điện phân hết, nước tham gia phản ứng ở cả 2 điện cực
Gọi mol H2 thoát ra ở catot là x, mol O2 thoát ra ở anot là y. Ta có:

Bảo toàn e: 0,2 + 2x = 0,4 + 4y (1)
Tổng khối lượng giảm: 64.0,1 + 2x + 71.0,2 = 34,3 (2)
Giải hệ phương trình (1)và (2) ta được: x = 0,85; y = 0,375
Sau khi điện phân trong dung dịch có:
K+ (0,4 mol); NO3- ( 0,2 mol); OH- ( 2.0,85 = 1,7 mol); H+ (4.0,375 = 1,5 mol)
Sau phản ứng trên còn dư 0,2 mol OH-
⇒ Dung dịch cuối cùng có K+( 0,4 mol); NO3- ( 0,2 mol); OH- ( 0,2 mol)
⇒ Có 0,2 mol KNO3 và 0,2 mol KOH
Nồng độ các chất còn lại trong dung dịch là: KNO3 0,2 M; KOH 0,2 M
Bài 8: Một học sinh đã đưa ra các phương án để điều chế đồng như sau :
(1) Điện phân dung dịch CuSO4.
(2) Dùng kali cho vào dung dịch CuSO4.
(3) Dùng cacbon khử CuO ở nhiệt độ cao.
(4) Dùng nhôm khử CuO ở nhiệt độ cao.
Trong các phương án điều chế trên, có bao nhiêu phương án có thể áp dụng đề điều chế đồng ?
A, 1 B. 2 C. 3 D. 4
Đáp án: C
Bài 9: Một nhóm học sinh đã đề xuất các cách điều chế Ag từ AgNO3 như sau :
(1) Cho kẽm tác dụng với dung dịch AgNO3.
(2) Điện phân dung dịch AgNO3.
(3) Cho dung dịch AgNO3 tác dụng với dung dịch NaOH sau đó thu lấy kết tủa đem nhiệt phân.
(4) Nhiệt phân AgNO3.
Trong các cách điều chế trên, có bao nhiêu cách có thể áp dụng để điều chế Ag từ AgNO3 ?
A. 1 B. 2 C. 3 D. 4
Đáp án: D
Các phản ứng:
1. Zn + 2AgNO3 → Zn(NO3)2 + 2Ag
2. 4AgNO3 + 2 H2O → 4Ag + 4HNO3 + O2
3. 2AgNO3 + 2NaOH → Ag2O + H2O + 2 NaNO3
2Ag2O → O2 + 4Ag
4. 2AgNO3 → 2Ag + 2NO2 + O2
Bài 10:
Điện phân nóng chảy NaOH và NaCl
4NaOH → 4Na + O2 + 2H2O
2NaCl → 2Na + Cl2
Bài 11: Để điều chế Ca từ CaCO3 cần thực hiện ít nhất mấy phản ứng ?
A. 2 B, 3 C. 4 D. 5
Đáp án: A
phản ứng (1): CaCO3 + 2HCl → CaCl2 + CO2 + H2O
Phản ứng (2): CaCl2 → Ca + Cl2
Bài 12: Những kim loại nào sau đây có thể được điều chế từ oxít bằng phương pháp nhiệt luyện nhờ chất khử CO?
A, Zn, Mg, Fe
B, Ni, Cu, Ca
C. Fe, Ni Zn
D. Fe, Al, Cu
Đáp án: C
Bài 13: Khẳng định nào sau đây không đúng
A, Khí điện phân dung dịch Zn(NO3)3 sẽ thu được Zn ở catot.
B, Có thể điều chế Ag bằng cách nhiệt phân AgNO3 khan.
C, Cho một luồng H2 dư qua bột Al2O3 nung nóng sẽ thu được Al.
D, Có thể điều chế đồng bằng cách dùng kẽm để khử ion Cu2+ trong dung dịch muối.
Đáp án: C
Bài 14: Cho các kim loụl : Li, Na, Cu, Al, Fe, Cu, Ag, Pt. Bằng phương pháp điện phân có thể điều chế được bao nhiêu kim loại trong số các kim loại trên ?
A, 3 B 4 C. 6 D. 8
Đáp án: D
Bài 15: Điện phân một dung dịch chứa đồng thời các cation Mg2+, Fe3+, Zn2+ , Pb2+ , Ag+. Thứ tự các kim loại sinh ra ở catot lần lượt là
A. Ag, Fe, Pb, Zn, B. Ag, Pb, Fe, Zn.
C Ag, Fe, Pb, Zn, Mg. D.Ag, Pb, Fe, Zn, Mg.
Đáp án: C
Bài 16: Điện phân (với cực điện trơ, mồng ngăn xốp) dung dịch gồm 0,2 mol Fe2(SO)4, 0,2 mol CuSO4 và 0,4 mol NaCl. Biết rằng hiệu suất điện phân đạt 100%. Điều khẳng định nào sau đây là đúng ?
A. Khi khối lượng catot tăng 12,8 gam thì dung dịch hoàn toàn chỉ có màu nâu vàng.
B. Khi khối lượng calot tăng lên 6,4 gam thì đã có 19300 culong chạy qua bình diện phân.
C. Khi có 4,48 lít khi (đktc) thoát ra ở anot thì khối lượng catot không thay đổi.
D. Khi có khi bắt dầu thoát ra ở catot thì đã có 8,96 lít khí (đktc) thoát ra ở anot.
Đáp án: C
tại catot sẽ lần lượt xảy ra các quá trình:
(1) Fe3+ +1e →Fe2+ (2) Cu2+ + 2e →Cu
(3) Fe2+ + 2e →Fe (4) 2H2O + 2e →H2 + 2OH-
Tại anot sẽ lần lượt xảy ra các quá trình:
a) 2Cl- → Cl2 + 2e b) 2H2O → 4H+ + O2 + 4e
Trong dung dịch ban đầu có 0,4 mol Fe3+ , 0,2 mol Cu2+ , 0,4 mol Cl- và các ion khác không tham gia phản ứng điện phân
Khi catot tăng 112,8 gam, tức là Cu2+ vừa hết, phản ứng (2) vừa kết thúc. Khi đó dung dịch chỉ có mù trắng xanh của Fe2+ nên phưng án A sai
Khi khối lượng catot tăng lên 6,4 gam, tức là đã có 0,1 mol Cu2+ bị điện phân. Vậy phản ứng (1) đã xảy ra hết, phản ứng (2) xảy ra một phần
Áp dụng công thức : q = ∑ni ziF
Trong đó ni là số mol chất i (phân tử hoặc ion) bị điện phân, zi là số e của chất i trao đổi ở điện cực
Ta có: q = (0,4.1 + 0,1.2).96500= 57900 (C)
Phương án B sai
Khi có 4,48 lít khí thoát ra ở anot, tức là có 0,2 mol khí thoát ra suy ra phản ứng (a) xảy ra hoàn toàn và vừa đủ. Tại anot có 0,4 mol e trao đổi.
Đông thời tại catot phản ứng (1) xảy ra hoàn toàn và vừa đủ. Chưa có kim loại kết tử trên điện cực. Phương án C đúng
Khi có khí bắt đầu thoát ra ở catot tức là các phản ứng (1) (2) (3 ) (4) đã xyar ra oàn toàn. Số e trao đổi ở catot là 1,4 mol.
Tại anot, phản ứng (a) đã xảy ra hoàn toàn và có 0,4 mol e đã tiêu thụ trong phản ứng (a), sinh ra 0,2 mol Clo
Số e tiêu thụ cho phản ứng (b) sẽ là 1 mol. Vậy có 0,25 mol khí oxi sinh ra.
Tổng số mol khí sinh ra tại anot trong trường hợp này là 10,08 lít. Phương án D sai