Với tóm tắt lý thuyết Hóa học lớp 12 Lý thuyết Luyện tâp: Điều chế kim loại và sự ăn mòn kim loại (mới 2022 + 15 câu trắc nghiệm) hay, chi tiết hay, chi tiết cùng với 15 câu hỏi trắc nghiệm chọn lọc có đáp án giúp học sinh nắm vững kiến thức trọng tâm, ôn luyện để học tốt môn Hóa học lớp 12.
Hóa học 12 Bài 23: Lý thuyết Luyện tâp: Điều chế kim loại và sự ăn mòn kim loại
A. Lý thuyết Lý thuyết Luyện tâp: Điều chế kim loại và sự ăn mòn kim loại
ĐIỀU CHẾ KIM LOẠI
Khử ion kim loại thành nguyên tử.
Mn+ + ne → M
1. Phương pháp thuỷ luyện
Nguyên tắc: Dùng những dung dịch thích hợp như: H2SO4, NaOH, NaCN, … để hoà tan kim loại hoặc các hợp chất của kim loại và tách ra khỏi phần không tan có ở trong quặng. Sau đó khử những ion kim loại này trong dung dịch bằng những kim loại có tính khử mạnh như Fe, Zn, …
Phạm vi áp dụng: Thường sử dụng để điều chế các kim loại có tính khử yếu.
Ví dụ:
Fe + CuSO4 → FeSO4 + Cu↓
Fe + Cu2+ → Fe2+ + Cu↓
2. Phương pháp nhiệt luyện
Nguyên tắc: Khử ion kim loại trong hợp chất ở nhiệt độ cao bằng các chất khử như C, CO, H2 hoặc các kim loại hoạt động.
Phạm vi áp dụng: Sản xuất các kim loại có tính khử trung bình (Zn, FE, Sn, Pb, …) trong công nghiệp.
Ví dụ:
3. Phương pháp điện phân
a. Điện phân hợp chất nóng chảy
Nguyên tắc: Khử các ion kim loại bằng dòng điện bằng cách điện phân nóng chảy hợp chất của kim loại.
Phạm vi áp dụng: Điều chế các kim loại hoạt động hoá học mạnh như K, Na, Ca, Mg, Al.
Ví dụ: Điện phân MgCl2 nóng chảy để điều chế Mg.
Phương trình điện phân:
b. Điện phân dung dịch
Nguyên tắc: Điện phân dung dịch muối của kim loại.
Phạm vi áp dụng: Điều chế các kim loại có độ hoạt động hoá học trung bình hoặc yếu.
Ví dụ: Điện phân dung dịch CuCl2 để điều chế kim loại Cu.
Phương trình điện phân:
Tính lượng chất thu được ở các điện cực
Dựa vào công thức Farađây: 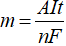
m: Khối lượng chất thu được ở điện cực (g).
A: Khối lượng mol nguyên tử của chất thu được ở điện cực.
n: Số electron mà nguyên tử hoặc ion đã cho hoặc nhận.
I: Cường độ dòng điện (ampe).
t: Thời gian điện phân (giấy).
F: Hằng số Farađây (F = 96.500).
SỰ ĂN MÒN KIM LOẠI
- Ăn mòn kim loại là sự phá hủy kim loại hoặc hợp kim dưới tác dụng của môi trường xung quanh.
- Ăn mòn kim loại gồm ăn mòn hóa học và ăn mòn điện hóa.
1. Ăn mòn hóa học
a. Nguyên nhân: do kim loại có phản ứng hóa học trực tiếp với các chất ở môi trường xung quanh.
b. Điều kiện: kim loại được đặt trong môi trường có chứa chất oxi hóa mà kim loại có thể tham gia phản ứng thường là chất khí, hơi nước, dung dịch axit...
c. Bản chất: là phản ứng oxi hóa - khử trong đó kim loại đóng vai trò chất khử. Electron chuyển trực tiếp từ kim loại vào môi trường.
2. Ăn mòn điện hóa
a. Khái niệm
- Ăn mòn điện hóa là sự phá hủy kim loại hoặc hợp kim do tiếp xúc với dung dịch chất điện li tạo nên dòng điện.
b. Điều kiện xảy ra sự ăn mòn điện hóa
+ Có 2 điện cực khác nhau về bản chất (kim loại + kim loại; kim loại + phi kim; kim loại + hợp chất).
+ 2 điện cực phải được tiếp xúc điện với nhau.
+ 2 điện cực cùng được tiếp xúc với dung dịch chất điện li (không khí ẩm).
c. Ăn mòn điện hóa học hợp kim của sắt (gang, thép) trong không khí ẩm
Sự ăn mòn điện hóa học các hợp kim của sắt (gang, thép) trong không khí ẩm có ảnh hưởng đặc biệt nghiêm trọng đối với nền kinh tế của các quốc gia.
- Ở cực âm xảy ra sự oxi hóa: Fe → Fe2+ + 2e
- Ở cực dương xảy ra sự khử: O2 + 2H2O + 4e → 4OH-
Ion Fe2+ tan vào dung dịch chất điện li có hòa tan khi oxi. Tại đây, ion Fe2+ tiếp tục bị oxi hóa dưới tác dụng của ion OH- tạo ra gỉ sắt có thành phần chủ yếu là Fe2O3.nH2O
d. Cơ chế của quá trình ăn mòn điện hóa
+ Kim loại mạnh đóng vai trò là cực âm (anot).
+ Kim loại yếu hơn hoặc phi kim đóng vai trò cực dương(catot).
+ Tại cực âm, kim loại mạnh bị ăn mòn (bị oxi hóa).
M → Mn+ + ne
+ Tại cực dương, môi trường bị khử:
Môi trường axit:
2H+ + 2e → H2
Môi trường trung tính, bazơ:
2H2O + O2 + 4e → 4OH-
(phản ứng phụ): Mn+ + nOH- → M(OH)n (tạo gỉ)
e. Bản chất của ăn mòn điện hóa: là sự oxi hóa kim loại ở cực âm và sự khử môi trường ở cực dương. Electron được chuyển từ kim loại mạnh sang kim loại yếu (hoặc phi kim) rồi vào môi trường.
Để bảo vệ kim loại khỏi sự ăn mòn có thể sử dụng các phương pháp sau:
1. Phương pháp bảo vệ bề mặt
- Cách li kim loại với môi trường: sơn, mạ, tráng, nhúng nhựa...
- Dùng chất kìm hãm.
- Tăng khả năng chịu đựng: hợp kim chống gỉ.
2. Phương pháp điện hóa: dùng kim loại mạnh hơn kim loại ở cực âm không tác dụng với nước gắn vào vật bị ăn mòn phần chìm trong dung dịch điện li (anot hi sinh).
Ví dụ: Để bảo vệ vỏ tàu biển bằng thép, người ta gắn các lá Zn vào phía ngoài vỏ tàu ở phần chìm trong nước biển (nước biển là dung dịch chất điện li). Phần vỏ tàu bằng thép là cực dương, các lá Zn là cực âm.
- Ở anot (cực âm): Zn bị oxi hóa Zn → Zn2+ + 2e
- Ở catot (cực dương): O2 bị khử 2H2O + O2 + 4e → 4OH-
Kết quả là vỏ tàu được bảo vệ, Zn là vật hi sinh, nó bị ăn mòn. Nhưng tốc độ ăn mòn điện hóa của kẽm trong điều kiện này tương đối nhỏ và vỏ tàu được bảo vệ trong thời gian dài. Sau một thời gian nhất định, người ta thay những lá Zn bị ăn mòn bằng những lá Zn khác.
B. Trắc nghiệm Luyện tâp: Điều chế kim loại và sự ăn mòn kim loại
Bài 1: Quấn một sợi dây kẽm quanh một thanh thép (là hợp kim của sắt và cacbon) và để ngoài không khi. Hiện tượng quan sát được là:
A. sợi dây kẽm bị ăn mòn.
B. kim loại sắt trong thanh thép bị ăn mòn,
C. sợi dây kẽm và sắt trong thanh thép bị ăn mòn.
D. hiện tượng ăn mòn không xây ra.
Đáp án: A
Bài 2: Một mẩu kim loại Ag dạng bột có lẫn Fe, Cu. Để loại bỏ tạp chất mà không làm thay đổi khối lượng Ag ban đầu, có thể ngâm mẩu Ag trên vào lượng dư dung dịch nào sau đây ?
A. HNO3 B. HCl C. AgNO3 D. Fe(NO3)3
Đáp án: D
Khi cho hỗn hợp kim loại phản ứng với Fe(NO3)3:
Fe + 2Fe(NO3)3 → 3Fe(NO3)2
Cu + 2Fe(NO3)3 → 2Fe(NO3)2 + Cu(NO3)2
Bài 3: Sau một thời gian điện phân 450ml dd CuSO4 người ta thu được 1,12 lít khí(đktc) ở anôt. Ngâm một đinh sắt sạch trong dd còn lại sau khi điện phân. Phản ứng xong thấy khối lượng đinh sắt tăng 0,8 g. Nồng độ mol ban đầu của dd CuSO4 là
A. 1,2M B. 1M
C. 2M D. 0,4444M
Đáp án: C
(K): Cu2+ + 2e → Cu
(A): 2H2O → O2 (0,05) + 4H+ + 4e (0,2 mol)
Bảo toàn e: nCu2+(đp) = 1/2. ne = 0,1 mol
Dung dịch sau điện phân có Cu2+ dư (do khối lượng đinh sắt tăng) và H+ (0,2mol)
Fe (x) + Cu2+ → Fe2+ + Cu (x mol) (1)
Fe (0,1) + 2H+ (0,2 mol) → Fe2+ + H2 (2)
mđinh sắt giảm = mCu sinh ra(1) – mFe pư (1+2) = 64x – 56x – 0,1.56 = 0,8g
⇒ x = 0,8 mol
⇒ nCu2+ đầu = 0,8 + 0,1 = 0,9
⇒ CM = 0,9/0,45 = 2 M
Bài 4: Điện phân dung dịch CuSO4 trong thời gian 1930 giây, thu được 1,92 gam Cu ở catot (chưa thấy có khí thoát ra ở catot). Với hiệu suất quá trình điện phân là 80%, cường độ dòng điện chạy qua dung dịch điện phân là:
A. 3,75 ampe B. 1,875 ampe
C. 3,0 ampe D. 6,0 ampe
Đáp án: A
Theo định luật Faraday:
Bài 5: Hỗn hợp bột X gồm BaCO3, Fe(OH)2, Al(OH)3, CuO, MgCO3. Nung X trong không khí đến khối lượng không đổi được hỗn hợp rắn A1. Cho A1 vào nước dư khuấy đều được dung dịch B chứa 2 chất tan và phần không tan C1. Cho khí CO dư qua bình chứa C1 nung nóng được hỗn hợp rắn E (Cho các phản ứng xảy ra hoàn toàn). E chứa tối đa:
A. 1 đơn chất và 2 hợp chất.
B. 3 đơn chất.
C. 2 đơn chất và 2 hợp chất.
D. 2 đơn chất và 1 hợp chất.
Đáp án: D
X -to→ A1: BaO; Fe2O3; Al2O3; CuO; MgO
A1 -+H2O→ dd B: Ba(OH)2 , Ba(AlO2)2; C1: Fe2O3; CuO; MgO
C1 -+CO→ E: Fe, Cu, MgO
Bài 6: Khi điện phân một dung dịch chứa Na2SO4, Al2(SO4)3 và H2SO4, quá trình đầu tiên xảy ra ở catot là:
A. 2H2O + 2e → H2 + 2OH-
B. Na+ + 1e → Na
C. Al3+ + 3e → Al
D. 2H+ + 2e → H2
Đáp án: D
Bài 7: Cho khí CO (dư) đi qua ống sứ nung nóng đựng hồn hợp X gồm Al2O3 , MgO, Fe3O4 , CuO thu được chất rắn Y. Cho Y vào dung dịch NaOH (dư), khuấy kĩ, thấy còn lại phần không tan Z. Giả sử các phản ứng xảy ra hoàn toàn. Phần không tan Z gồm
A, MgO Fe, Cu B. Mg, Fe, Cu,
C. MgO, Fe3O4 Cu, D, Mg, FeO, Cu.
Đáp án: A
Bài 8: Hoà tan hồn hợp gồm FeCln, Fe 2(SO4)3, CuO2 và CuSO4 vào nước thành 200 ml dung dịch A. Điện phân 100 lít dung dịch A cho đến khi hết ion Cl thì dừng điện phân thấy catot tăng 6,4 gam, đồng thời khối lượng dung dịch giàm 17,05 gam. Dung dịch sau diện phân phản ứng với NaOH vừa đủ thu được kất tủa B, nung B trong không khí đến khối lượng không đổi thu được 16 gam hỗn hợp hai oxit kim loại, cô cạn 100 ml dung dịch A thu được m gam hỗn hợp muối khan. Giá trị của m là :
A. 48,25. B. 57,85. C. 67,45. D. 38,65.
Đáp án: A
tại catot có thể lần lượt xảy ra các quá trình:
(1) Fe3+ +1e → Fe2+
(2) Cu2+ + 2e → Cu
(3) Fe2+ + 2e → Fe
(4) 2H2O + 2e → OH- + H2
Tại anot có thể lần lượt xảy ra các quá trình:
2Cl- →Cl2 + 2e
2H2O → 4H+ + O2 + 4e
Sau khi điện phân A, cho dung dịch này phản ứng với NaOH thu được kết tủa B, nung B đến khối lượng không đổi thu được hỗn hợp 2 oxit. Trong A có 2 loại ion kim loại.
Mặt khác, khi điện phân dung dịch A cho đến khi hết ion Cl- thì catot tăng 6,4 gam.
⇒ Quá trình (2) đã xảy ra một phần, Cu2+ vẫn còn trong dung dịch sau điện phân.
Gọi số mol Fe3+, Cu2+, Cl-, SO42- trong 100ml dung dịch A lần lượt là a,b,c,d.
Khi điện phân hết Cl-, nCu2+ đã bị điện phân = 0,1 mol
Theo bảo toàn e: số e do Fe3+ và Cu2+ nhận bằng số mol Cl- nhường.
a + 0,1.2 = c (1)
Khối lượng dung dịch giảm gồm Cu2+ và Cl- đã phản ứng và bị tách ra khỏi dung dịch
6,4 + 35,5c = 17,05 (2)
Sau khi điện phân A, cho dung dịch này phản ứng với NaOH thu được kết tủa B, nung B đến khối lượng không đổi được 16 gam 2 oxit.
Suy ra: 160,0,5a + 80(b – 0,1) = 16 (3)
Theo định luật bảo toàn điện tích, đối với dung dịch A ta có:
3a + 2b = c + 2d (4)
Giải hệ phương trình ta được:
a = 0,1; b = 0,2; c= 0,3; d = 0,2
Khối lượng muối trong 100ml dung dịch A là 48,25 gam
Bài 9: Điện phân 200 ml dung dịch CuSO4 0,5M và FeSO4 0,3M với điện cực trơ và dòng điện I = 5A. Sau 60 phút, khối lượng catot tăng lên là:
A. 5,97 gam B. 6,40 gam. C, 3,36 gam. D. 9,76 gam.
Đáp án: A
Sau 60 phút điện phân, điện lượng đi qua dung dịch điện phân là:
q = It = 18000(C)
CuSO4 chưa bị điện phân hết.
Phản ứng điện phân:
Cu2+ + 2e → Cu
Lượng kim loại thoát ra ở catot là:
mCu = 5,97 gam
Bài 10: Cho 1,12 gam bột Fe và 0,24 gam bột Mg tác dụng với 250 ml dung dịch CuSO4, khuấy nhẹ cho đen hết màu xanh, nhận thấy khối lượng kim loại sau phàn ứng là 1,76 gam. Nồng độ đung dịch CuSO4 trước phản ứng là
A. 0,01 M B.0,02M C, 0,03M D. 0,04M
Đáp án: D
Mg + CuSO4 → MgSO4 + Cu (1)
Fe + CuSO4 → FeSO4 + Cu (2)
Nhận xét: khi cho bột kim loại vào dung dịch, khối lượng kim loại sau phản ứng sẽ tăng lên.
Ta có khoảng sau:
mkim loại sau pứ = 1,76 gam ⇒ Mg phản ứng vừa hết với CuSO4
⇒ nCuSO4 = nMg = 0,01 mol ⇒ CM CuSO4 = 0,04 M
Bài 11: Để chống ăn mòn cho các chân cột thu lôi bằng thép chôn dưới đất, người ta dùng phương pháp bảo vệ điện hoá. Trong thực tế, có thể dùng kim loại nào sau đây làm điện cực bảo vệ ?
A.Na B. Zn C. Sn D. Cu
Đáp án: B
Bài 12: Sơ đồ sau đây mô tả cách điều chế kim loại M :
4M(NO3 )n + 2 nH2 −đpdd→ 4M + 4nHNO3 + nO2
Trong số các kim loại Mg, Al, Fe, Ni, Cu, Ag, có bao nhiêu kim loại có thể áp dụng sơ đồ điều chế trên ?
A. 6 B. 5 C. 4 D. 3
Đáp án: C
Bài 13: Điện phân dung dịch muối MCln với điện cực trơ. .Khi ở catot thu được 16 gam kim loại M thì ở anot thu được 5,6 lít (đktc). Kim loại M là :
A. Mg. B. Cu. C. Ca. D. Zn.
Đáp án: B
Phản ứng điện phân:
⇒ chỉ có n = 2 và M = 64 phù hợp. Vậy kim loại M là Cu.
Bài 14: Một học sinh đã đưa ra các phương án điều chế kim loại Mg như sau :
(1) Kết tủa Mg(OH)2 từ dung dịch MgCl2, nhiệt phân lấy MgO rồi khử bằng H2 Ở nhiệt độ cao để điều chế Mg.
(2) Dùng kim loại mạnh đẩy Mg ra khỏi dung dịch MgCl2
(3) Diện phân dung dịch MgCl2 để thu được Mg.
(4) Cô cạn dung dịch MgCl2, điện phân nóng chảy để thu được Mg.
Trong các phương án trên có bao nhiêu phương án có thể áp dụng để điều chế Mg ?
A. 1 B. 2 C. 3 D. 4
Đáp án: A
Bài 15: Khi điện phân một dung dịch muối, giá trị pH ở khu vực gần một điện cực tăng lên. Dung dịch muối đem điện phân có thể là dung dịch nào sau đây ?
A. CuSO4 B. AgNO3 C. KCl D. K2SO4
Đáp án: C