Tailieumoi.vn giới thiệu Giải bài tập Hóa học lớp 12 Bài 21: Điều chế kim loại chính xác, chi tiết nhất giúp học sinh dễ dàng làm bài tập Điều chế kim loại lớp 12.
Bài giảng Hóa học 12 Bài 21: Điều chế kim loại
Giải bài tập Hóa học 12 Bài 21: Điều chế kim loại
Câu hỏi và bài tập (trang 98 SGK Hóa Học 12)
Bài 1 trang 98 SGK Hóa Học 12: Trình bày cách để
- Điều chế Ca từ CaCO3.
- Điều chế Cu từ CuSO4
Viết phương trình hoá học của các phản ứng.
Ghi nhớ:
- Phương pháp điện phân : điện phân nóng chảy muối clorua
- Cách điều chế Cu:
+ Phương pháp thủy luyện: Dùng kim loại mạnh đẩy Cu ra khỏi dd muối
+ Phương pháp nhiệt luyện: Dùng CO hoặc H2 khử CuO về Cu
+ Phương pháp điện phân: Điện phân các muối tan của đồng
Ghi nhớ:
- Phương pháp điện phân : điện phân nóng chảy muối clorua
- Cách điều chế Cu:
+ Phương pháp thủy luyện: Dùng kim loại mạnh đẩy Cu ra khỏi dd muối
+ Phương pháp nhiệt luyện: Dùng CO hoặc H2 khử CuO về Cu
+ Phương pháp điện phân: Điện phân các muối tan của đồng
Điều chế Ca từ CaCO3: Điện phân nóng chảy muối halogenua khan
Điều chế Cu từ CuSO4: Có thể dùng phương pháp: Điện phân dung dịch, thủy luyện, nhiệt luyện
Cách 1: Phương pháp thủy luyện : Fe + CuSO4 → FeSO4 + Cu↓
Cách 2: Phương pháp điện phân dung dịch
Cách 3: Nhiệt luyện:
CuSO4 + 2NaOH Cu(OH)2 + Na2SO4
Bài 2 trang 98 SGK Hóa Học 12: Từ Cu(OH)2, MgO, Fe2O3 hãy điều chế các kim loại tương ứng bằng một phương pháp thích hợp. Viết phương trình hóa học của phản ứng.
Phương pháp giải:
Viết phương trình điều chế Cu,Mg, Fe từ các chất cho ban đầu:
- Ghi nhớ:
+ Điều chế Mg bằng phương pháp điện phân nóng chảy muối clorua
+ Điều chế Cu, Fe bằng phương pháp thủy luyện, nhiệt luyện hoặc bằng phương pháp điện phân dung dịch.
Lời giải:
- Điều chế Cu bằng phương pháp nhiệt luyện
- Điều chế Mg bằng phương pháp điện phân nóng chảy
MgO + 2HCl → MgCl2 + H2O
- Điều chế Fe bằng phương pháp nhiệt luyện
Hoặc
Bài 3 trang 98 SGK Hóa Học 12: Một loại quặng sắt chứa 80% Fe2O3, 10% SiO2 và một số tạp chất khác không chứa Fe và Si. Hàm lượng các nguyên tố Fe và Si trong quặng này là
A. 56% Fe và 4,7% Si.
B. 54% Fe và 3,7% Si.
C. 53% Fe và 2,7% Si.
D. 52% Fe và 4,7% Si.
Phương pháp giải:
Giả sử có 100 gam quặng sắt thì khối lượng Fe2O3 là 80 gam và khối lượng SiO2 là 10 gam
Tính được nFe2O3 => nFe = ? => mFe = ?
Tính được nSiO2 => nSi = ? => mSi = ?
Áp dụng công thức tính thành phần phần trăm
Lời giải:
Giả sử có 100 gam quặng sắt thì khối lượng Fe2O3 là 80 gam và khối lượng SiO2 là 10 gam
Tính được nFe2O3 = 80: 160 = 0,5 (mol)
=> nFe = 2nFe2O3 = 2.0,5 = 1(mol) => mFe = 56 (g)
nSiO2 = 10 : 60 = 1/6 (mol)
=> nSi = nSiO2 = 1/6 (mol) => mSi = 1/6. 28 = 14/3 (g)
Đáp án A
Bài 4 trang 98 SGK Hóa Học 12: Để khử hoàn toàn 30 gam hỗn hợp gồm CuO, FeO, Fe3O4, Fe2O3, Fe, MgO cần dùng 5,6 lít khí CO (đktc). Khối lượng chất rắn thu được sau phản ứng là
A. 28 gam. B. 26 gam.
C. 24 gam. D. 22 gam.
Phương pháp giải:
Gọi công thức tổng quát của các oxit là RxOy
PTHH:
Từ PTHH trên => nCO2 = nCO => mCO2 =?
Áp dụng định luật bảo toàn khối lượng ta có:
mOxit + mCO = mR + mCO2
=> mR =?
Cách 2:
Quy đổi hỗn hợp về: M và O
(M, O) + CO
Khối lượng chất rắn thu được sau phản ứng = khối lượng hỗn hợp đầu - khối lượng O phản ứng với CO
=> Khối lượng chất rắn thu được sau phản ứng
Lời giải:
Cách 1:
PTHH tổng quát:
Từ phương trình trên => = nCO = = 0,25 (mol)
Áp dụng định luật bảo toàn khối lượng, ta có:
mhỗn hợp oxit + mCO → mchất rắn +
=> mchất rắn = mhỗn hợp oxit + mCO - mCO2
=30 - 0,25.44 + 0,25.28
= 26 (gam).
Đáp án B
Cách 2:
Quy đổi: 30 gam hỗn hợp thành M và O
(M, O) + CO
Ta có: nCO = = 0,25 (mol)
Khối lượng chất rắn thu được sau phản ứng = khối lượng hỗn hợp đầu - khối lượng O phản ứng với CO
m = 30 - 0,25 x 16 = 26 (gam)
Đáp án B
Bài 5 trang 98 SGK Hóa Học 12: Điện phân (điện cực trơ) dung dịch muối sunfat của một kim loại hoá trị II với dòng điện cường độ 3A. Sau 1930 giây điện phân thấy khối lượng catot tăng 1,92 gam.
a) Viết phương trình hoá học của phản ứng xảy ra tại mỗi điện cực và phương trình hoá học của sự điện phân.
b) Xác định tên kim loại.
Phương pháp giải:
a) Viết các bán phản ứng xảy ra các điện cực:
Tại catot (-): M2+ + 2e → M
Tại anot (+): 2H2O → 4H+ + O2 + 4e
PTHH phản ứng điện phân: 2MSO4 + 2H2O 2M +O2 + 2H2SO4
b) Áp dụng công thức:
m = => A =? => kim loại
Lời giải:
a) Catot: M2+ + 2e → M
Anot: 2H2O → 4H+ + O2 + 4e
PTHH của phản ứng điện phân:
2MSO4 + 2H2O 2M +O2 + 2H2SO4
b) m = => A = = 64 => Kim loại Cu
Lý thuyết Bài 21: Điều chế Kim loại
I. NGUYÊN TẮC ĐIỀU CHẾ KIM LOẠI
Khử ion kim loại thành nguyên tử.
Mn+ + ne → M
II.CÁC PHƯƠNG PHÁP ĐIỀU CHẾ KIM LOẠI
1. Phương pháp nhiệt luyện
- Đối tượng KL: KL có mức độ hoạt động trung bình
- Phương thức điều chế: khử ion kim loại trong hợp chất ở nhiệt độ cao bằng các chất khử thông thường như C, CO, H2, Al.
VD:
Fe2O3 + 3 CO 2Fe + 3CO2
2. Phương pháp thủy luyện
- Đối tượng KL: KL có mức độ hoạt động trung bình và yếu
- Phương thức điều chế: Khử những in kim loại cần điều chế bằng những kim loại có tính khử mạnh như Fe, Zn,....
VD:
Fe + CuSO4 → FeSO4 + Cu
3. Phương pháp điện phân
a) Điện phân nóng chảy:
- Đối tượng KL: KL có mức độ hoạt động mạnh
- Phương thức điều chế: Dùng dòng điện một chiều khử ion kim loại trong chất điện li nóng chảy (muối halogenua, oxit, hidroxit).
Ví dụ: Điện phân MgCl2 nóng chảy để điều chế Mg.
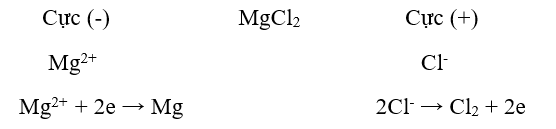
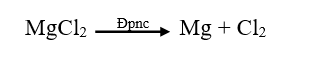
b) Điện phân dung dịch:
- Đối tượng KL: Dùng điều chế các kim loại yếu.
- Phương thức điều chế: Dùng dòng điện một chiều khử ion kim loại yếu trong dung dịch muối của nó.
Ví dụ: Điện phân dung dịch CuCl2 để điều chế kim loại Cu
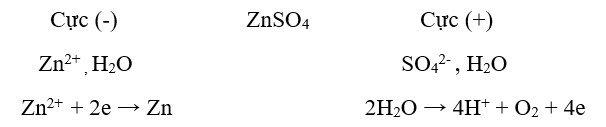
c) Tính lượng chất thu được ở các điện cực
- Dựa vào công thức Farađây:
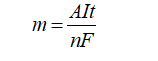
Trong đó:
m: Khối lượng chất thu được ở điện cực (g).
A: Khối lượng mol nguyên tử của chất thu được ở điện cực.
n: Số electron mà nguyên tử hoặc ion đã cho hoặc nhận.
I: Cường độ dòng điện (ampe).
t: Thời gian điện phân (giây).
F: Hằng số Farađây (F = 96500).
Phương pháp giải Bài 21: Điều chế kim loại
Dạng 1: Điều chế kim loại bằng phương pháp nhiệt luyện
* Một số lưu ý cần nhớ
- Điều chế kim loại bằng phương pháp nhiệt luyện là điều chế kim loại bằng cách khử oxi kim loại bằng H2, CO, C, Al.
=> Đây là phương pháp điều chế kim loại trung bình (đứng từ Zn trong dãy hoạt động trở đi)
Để làm được tốt dạng bài tập này, các em cần áp dụng linh loạt các định luật bảo toàn electron, bảo toàn điện tích và bảo toàn khối lượng.
* Một số ví dụ điển hình
Ví dụ 1: Khử hoàn toàn m gam Fe2O3 cần vừa đủ 4,704 lít khí CO (đktc). Giá trị của m là
Hướng dẫn giải chi tiết:
Khi oxit bị khử bởi CO:
nO(oxit) = nCO = 4,704/22,4 = 0,21 mol
BTNT "O": 3nFe2O3 = nO(oxit) = 0,21
=> nFe2O3 = 0,07 mol
=> m = 160.0,07 = 11,2 gam
Ví dụ 2: Hỗn hợp X gồm Fe, FeO, Fe2O3. Cho một luồng khí CO đi qua ống sứ đựng m g hỗn hợp X nung nóng. Sau khi kết thúc thí nghiệm thu được 64 g chất rắn A và 11,2 lít khí B (đktc) có tỉ khối so với hiđro là 20,4. Giá trị của a là
Hướng dẫn giải chi tiết:
Giả sử:
Ta có hệ phương trình:
BTKL:
→
Ví dụ 3: Cho một luồng khí CO đi qua ống sứ đựng m gam Fe2O3 nung nóng. Sau một thời gian thu được 10,44 gam chất rắn X gồm Fe, FeO, Fe2O3 và Fe3O4. Hòa tan hết X trong dung dịch HNO3 đặc, nóng thu được 4,368 lít NO2 (sản phẩm khử duy nhất ở đktc). Giá trị của m là
Hướng dẫn giải chi tiết:
nNO2 = 0,195 mol
Xét toàn bộ quá trình chỉ có CO cho e (tạo CO2) và HNO3 nhận e (tạo NO2)
Bảo toàn e: 2.nCO = nNO2 => nCO = 0,0975 mol
=> nCO2= nCO = 0,0975 mol
Bảo toàn khối lượng: mCO + mFe2O3 = mCO2 + mhh oxit
=> mFe2O3 = 0,0975.44 + 10,44 – 0,0975.28 = 12 gam
Dạng 2: Điều chế kim loại bằng phương pháp thủy luyện
* Một số lưu ý cần nhớ:
Cơ sở của phương pháp này là dùng những dung môi thích hợp như dung dịch H2SO4, NaOH, NaCN,... để hoà tan kim loại hoặc hợp chất của kim loại và tách ra khỏi phần không tan có trong quặng. Sau đó khử những ion kim loại này bằng kim loại có tính khử mạnh như Fe, Zn, ...
Ví dụ : Dùng Fe để khử ion Cu2+ trong dung dịch muối đồng.
Fe + CuSO4 → FeSO4 + Cu¯
Fe + Cu2+ → Fe2+ + Cu¯
* Một số ví dụ điển hình:
Ví dụ 1: Cho thanh sắt Fe vào dung dịch X chứa 0,1 mol AgNO3 và 0,2 mol Cu(NO3)2. Khi thấy thanh kim loại tăng lên 8,8 gam thì dừng lại. Tính khối lượng kim loại bám vào thanh sắt
Hướng dẫn giải chi tiết:
nAg+ = 0,1 mol; nCu2+ = 0,2 mol
Nếu Ag+ phản ứng hết :
Fe + 2Ag+ → Fe2+ + 2Ag
0,05 ← 0,1 → 0,1
=> mtăng = 0,1.108 – 0,05.56 = 8 < 8,8
=> Ag+ phản ứng hết; Cu2+ phản ứng 1 phần
Fe + Cu2+ → Fe2+ + Cu
x → x → x
=> mtăng = 64x – 56x = 8x
=> tổng khối lượng tăng ở 2 phản ứng là:
mtăng = 8 + 8x = 8,8 => x = 0,1 mol
=> mkim loại bám vào = mAg + mCu = 17,2 gam
Ví dụ 2: Cho 0,56 gam bột sắt vào 100 ml dung dịch gồm AgNO3 0,3M và Cu(NO3)2 0,5M. Sau khi các phản ứng xảy ra hoàn toàn thu được m gam chất rắn X. Giá trị của m là
Hướng dẫn giải chi tiết:
nFe = 0,01 mol; nAgNO3 = 0,03 mol; nCu(NO3)2 = 0,05 mol
Ta thấy : ne Fe cho tối đa = 0,01.3 = 0,03 mol = ne Ag+ nhận tối đa
=> Fe phản ứng hết với Ag, tạo thành Fe3+ và Ag
=> nAg = nAgNO3 = 0,03 mol => m = 0,03.108 = 3,24 gam
Ví dụ 3: Cho m gam Zn vào dung dịch chứa 0,15 mol FeCl3. Sau khi phản ứng xảy ra hoàn toàn thu được 3,92 gam chất rắn. Giá trị của m là:
Hướng dẫn giải chi tiết:
nFeCl3 = 0,15mol => mFe tối đa sinh ra = 0,15 . 56 = 8,4 gam > 3,92 gam
=> chất rắn chỉ có Fe, còn Zn đã phản ứng hết
nFe = 3,92 / 56 = 0,07 mol
FeCl3 phản ứng với Zn tạo thành Fe (0,07 mol) và FeCl2 (0,15 – 0,07 = 0,08 mol)
Bảo toàn e: 2nZn = 3nFe + nFeCl2 => nZn = 0,145 mol
=> m = 9,425 gam
Dạng 3: Điều chế kim loại bằng phương pháp điện phân
* Một số lưu ý cần nhớ:
- Điện phân là quá trình sử dụng điện năng để tạo ra sự biến đổi hóa học
- Người ta dùng phương pháp điện phân nóng chảy để điều chế những kim loại mạnh (kim loại kiềm, kiềm thổ, ...)
VD1: 2NaCl 2Na + Cl2
- Điện cực âm: Catot , nơi diễn ra quá trình khử: Na+ + 1e → Na
- Điện cưc dương: Anot, nơi diễn ra quá trình oxi hóa: 2Cl- → Cl2 + 2e
* Lưu ý: Dấu của cực trong quá trình điện phân, ngược với pin điện hóa.
VD2: Điện phân dung dịch CuSO4
( - ): Cực catot: Cu2+ +2e → Cu
( + ) Cực anot: 2H2O → 4H+ + O2 + 4e
=> Ta có phương trình điện phân:
CuSO4 + H2O → Cu + H2SO4 + ½ O2
* Lưu ý:
Trong dung dịch
- Ion kim loại từ Zn trở đi sẽ bị điện phân, các ion KL sẽ bị điện phân lần lượt từ Ag+ > Fe3+ > Cu2+ > H+..
- Anion có khả năng bị điện phân trong dung dịch: S2- > I- > Br- > Cl- > OH-
(Các anion SO42-, NO3-, ClO4- không bị điện phân trong dung dịch)
- Công thức Faraday:
Trong đó:
m : Khối lượng chất thu được ở điện cực (gam)
A : Khối lượng mol của chất thu được ở điện cực
F : Hằng số Farađay có giá trị bằng 96500.
n : Số electron mà nguyên tử hoặc ion đã cho hoặc nhận (số electron trao đổi)
I : Cường độ dòng điện (ampe)
t : Thời gian điện phân (giây)
* Một số ví dụ điển hình:
Ví dụ 1: Điện phân 400 ml dung dịch CuSO4 0,2M với cường độ dòng điện 10A trong một thời gian thu được 0,224 lít khí (đktc) ở anot. Biết điện cực đã dùng là điện cực trơ và hiệu suất điện phân là 100%. Khối lượng catot tăng là
Hướng dẫn giải chi tiết:
Khí thu được ở anot là O2 →
Tại anot (+):
Ta thấy: → Tại catot Cu2+ chưa bị điện phân hết
Tại catot (-):
0,04 → 0,02 (mol)
→ mcatot tăng = mCu = 0,02.64 = 1,28 gam
Ví dụ 2: Điện phân dung dịch CuSO4 với điện cực trơ, cường độ dòng điện 10A. Khi ở anot có 4 gam khí oxi bay ra thì ngưng. Phát biểu nào sau đây là đúng ?
A. Khối lượng đồng thu được ở catot là 16 gam.
B. Thời gian điện phân là 9650 giây.
C. pH của dung dịch trong quá trình điện phân luôn giảm.
D. Không có khí thoát ra ở catot.
Hướng dẫn giải chi tiết:
nO2 = 0,125 mol
Catot: Cu2+ + 2e → Cu
Anot: 2H2O → O2 ↑ + 4H+ + 4e
=> ne trao đổi = 4.nO2 = 0,5 mol
=> nCu = 0,5 / 2 = 0,25 mol => m = 16 gam => A đúng
t = n.F / I = 4825s => B sai
+) pH của dung dịch ban đầu giảm, khi hết Cu2+ thì nước điện phân ở catot tạo OH-, ở anot tạo ra H+ và nOH- = nH+ nên pH không đổi => C sai
+) hết Cu2+, nước điện phân ở catot tạo khí H2 => D sai
Ví dụ 3: Hòa tan hoàn toàn hỗn hợp X gồm KCl và CuSO4 vào nước, thu được dung dịch Y. Điện phân dung dịch Y với điện cực trơ màng ngăn xốp, đến khi H2O bị điện phân tại cả 2 điện cực thì dừng điện phân. Số mol khí ở anot thoát ra bằng 4 lần số mol khí thoát ra tại catot. Phần trăm khối lượng của CuSO4 trong X là
Hướng dẫn giải chi tiết:
Tại A có 2Cl- → Cl2 + 2e
Tại K có Cu+2 +2e → Cu
2H2O + 2e → 2OH- +H2
Bảo toàn e có 2nCl2 = 2nCu + 2nH2
Vì nCl2 = 4nH2 nên 2nCl2 = 2nCu + ½ nCl2 → nCu = ¾ . nCl2
→
→