Với tóm tắt lý thuyết Hóa học lớp 10 Bài 16: Ôn tập Chương 4 sách Kết nối tri thức hay, chi tiết cùng với bài tập trắc nghiệm chọn lọc có đáp án giúp học sinh nắm vững kiến thức trọng tâm, ôn luyện để học tốt môn Hóa học 10.
Lý thuyết Hóa học lớp 10 Bài 16: Ôn tập Chương 4
A. Lý thuyết Hóa học Chương 4: Phản ứng oxi hóa – khử
I. Một số khái niệm
Chất khử là chất nhường electron, chất oxi hóa là chất nhận electron.
Quá trình oxi hóa là quá trình chất khử nhường electron, quá trình khử là quá trình chất oxi hóa nhận electron.
Phản ứng oxi hóa – khử là phản ứng hóa học xảy ra đồng thời quá trình quá trình nhường electron và quá trình nhận electron.
Chú ý: Dấu hiệu để nhận biết phản ứng oxi hóa – khử là có sự thay đổi số oxi hóa của các nguyên tử.
II. Lập phương trình hóa học của phản ứng oxi hóa – khử
Nguyên tắc: “Tổng số electron chất khử nhường bằng tổng số electron chất oxi hóa nhận”.
Các bước lập phương trình hóa học của phản ứng oxi hóa – khử:
Ví dụ: Cân bằng phương trình hóa học của phản ứng sau theo phương pháp thăng bằng electron: Cu + HNO3 Cu(NO3)2 + NO + H2O.
Bước 1: Xác định các nguyên tử có sự thay đổi số oxi hóa, từ đó xác định chất oxi hóa, chất khử:
+ + + H2O.
Cu: chất khử; HNO3: chất oxi hóa.
Bước 2: Biểu diễn quá trình oxi hóa, quá trình khử:
Bước 3: Tìm hệ số thích hợp cho chất khử và chất oxi hóa dựa trên nguyên tắc: Tổng số electron chất khử nhường bằng tổng số electron chất oxi hóa nhận.
Bước 4: Đặt hệ số của chất oxi hóa và chất khử vào sơ đồ phản ứng, từ đó tính ra hệ số của các chất khác có mặt trong phương trình hóa học. Kiểm tra sự cân bằng số nguyên tử của các nguyên tố ở hai vế.
3Cu + 8HNO3 3Cu(NO3)2 + 2NO + 4H2O
B. Trắc nghiệm Hóa học Chương 4: Phản ứng oxi hóa – khử
Câu 1. Số oxi hóa của N trong phân tử KNO3 là
A. –2.
B. +2.
C. +4.
D. +5.
Đáp án: D
Giải thích:
Trong hợp chất, số oxi hóa của K là +1, số oxi hóa của O là –2.
Số oxi hóa của từng nguyên tử: ![]() .
.
Ta có: (+1) + x + (–2)×3 = 0 x = +5.
Câu 2. Số oxi hóa của P trong phân tử H3PO4 là
A. +5.
B. +3.
C. +2.
D. +1.
Đáp án: A
Giải thích:
Trong hợp chất, số oxi hóa của H là +1, số oxi hóa của O là –2.
Số oxi hóa của từng nguyên tử: ![]() .
.
Ta có: (+1)×3 + x + (–2)×4 = 0 x = +5.
Câu 3. Số oxi hóa của S trong ion S2- là
A. +2.
B. –2.
C. +3.
D. 0.
Đáp án: B
Giải thích:
Trong ion đơn nguyên tử, số oxi hóa của nguyên tử bằng điện tích ion.
Số oxi hóa của S trong ion S2- là –2.
Câu 4. Số oxi hóa của S trong ion ![]() là
là
A. –2.
B. +2.
C. +4.
D. +6.
Đáp án: D
Giải thích:
Số oxi hóa của O là – 2.
Gọi số oxi hóa của S trong ion đa nguyên tử ![]() là x.
là x.
Trong ion đa nguyên tử, tổng số oxi hóa của các nguyên tử bằng điện tích ion.
Ta có: x + (–2)×4 = –2 x = +6.
Câu 5. Trong phản ứng hóa học: Zn + H2SO4 ZnSO4 + H2, mỗi nguyên tử Zn đã
A. nhường 2 electron.
B. nhận 2 electron.
C. nhường 1 electron.
D. nhận 1 electron.
Đáp án: A
Giải thích:
Phương trình hóa học: ![]() .
.
Trong phản ứng trên, mỗi nguyên tử Zn nhường 2 electron: ![]()
Câu 6. Trong phản ứng oxi hóa – khử, chất oxi hóa là chất
A. nhường electron.
B. nhận electron.
C. nhường proton.
D. nhận proton.
Đáp án: B
Giải thích:
Trong phản ứng oxi hóa – khử, chất khử là chất nhường electron, chất oxi hóa là chất nhận electron.
Câu 7. Dấu hiệu để nhận biết phản ứng oxi hóa – khử là
A. có sự thay đổi hóa trị của các nguyên tử.
B. có sự thay đổi số oxi hóa của các nguyên tử.
C. không có sự thay đổi hóa trị của các nguyên tử.
D. không có sự thay đổi số oxi hóa của các nguyên tử.
Đáp án: B
Giải thích:
Phản ứng oxi hóa – khử là phản ứng hóa học xảy ra đồng thời quá trình quá trình nhường electron và quá trình nhận electron.
Dấu hiệu để nhận biết phản ứng oxi hóa – khử là có sự thay đổi số oxi hóa của các nguyên tử.
Câu 8. Quá trình nào sau đây là quá trình khử?
A. Cu Cu2+ +2e.
B. Na Na+ +1e.
C. 2H+ +2e H2.
D. Fe Fe3+ + 4e.
Đáp án: C
Giải thích:
Quá trình oxi hóa là quá trình chất khử nhường electron, quá trình khử là quá trình chất oxi hóa nhận electron.
Quá trình khử: 2H+ +2e H2.
Các quá trình còn lại là quá trình oxi hóa.
Câu 9. Phát biểu nào sau đây là đúng?
A. Trong phân tử các hợp chất, thông thường số oxi hóa của hydrogen là –2, của oxygen là +1, các kim loại điển hình có số oxi hóa âm.
B. Trong phân tử các hợp chất, thông thường số oxi hóa của hydrogen là +1, của oxygen là –2, các kim loại điển hình có số oxi hóa âm.
C. Trong phân tử các hợp chất, thông thường số oxi hóa của hydrogen là –2, của oxygen là +1, các kim loại điển hình có số oxi hóa dương.
D. Trong phân tử các hợp chất, thông thường số oxi hóa của hydrogen là +1, của oxygen là –2, các kim loại điển hình có số oxi hóa dương.
Đáp án: D
Giải thích:
Trong phân tử các hợp chất, thông thường số oxi hóa của hydrogen là +1, của oxygen là – 2, các kim loại điển hình có số oxi hóa dương và có giá trị bằng số electron hóa trị.
Câu 10. Trong hợp chất, số oxi hóa thường gặp của kim loại kiềm thổ là
A. +1.
B. +2.
C. –2.
D. +3.
Đáp án: B
Giải thích:
Trong hợp chất, số oxi hóa thường gặp của kim loại kiềm thổ là +2.
Chú ý:

Câu 11. Trong phản ứng hóa học: 2K + 2H2O 2KOH + H2, chất oxi hóa là
A. H2O.
B. KOH.
C. K.
D. H2.
Đáp án: A
Giải thích:
Phương trình hóa học: ![]() .
.
Chất khử là chất nhường electron (số oxi hóa tăng sau phản ứng); chất oxi hóa là chất nhận electron (số oxi hóa giảm sau phản ứng).
® K là chất khử; H2O là chất oxi hóa.
Câu 12. Cho nước Cl2 vào dung dịch NaI xảy ra phản ứng hóa học:
Cl2 + 2NaI 2NaCl + I2
Trong phản ứng hóa học trên, xảy ra quá trình oxi hóa chất nào?
A. Cl2.
B. NaI.
C. NaCl.
D. I2.
Đáp án: B
Giải thích:
Phương trình hóa học: ![]() .
.
Quá trình oxi hóa là quá trình chất khử nhường electron, quá trình khử là quá trình chất oxi hóa nhận electron.
Vậy:
![]() : quá trình oxi hóa.
: quá trình oxi hóa.
![]() : quá trình khử.
: quá trình khử.
Câu 13. Phản ứng nào sau đây là phản ứng oxi hóa – khử?
A. Fe2O3 + 3CO ![]() 2Fe + 3CO2.
2Fe + 3CO2.
B. CuO + 2HCl CuCl2 + H2O.
C. CaO + CO2 CaCO3.
D. CO2 + 2NaOH Na2CO3 + H2O.
Đáp án: A
Giải thích:
![]() : có sự thay đổi số oxi hóa của nguyên tử Fe (từ +3 về 0) và nguyên tử C (từ +2 lên +4) Đây là phản ứng oxi hóa – khử.
: có sự thay đổi số oxi hóa của nguyên tử Fe (từ +3 về 0) và nguyên tử C (từ +2 lên +4) Đây là phản ứng oxi hóa – khử.
![]() : không có nguyên tử nguyên tố nào thay đổi số oxi hóa ® không phải là phản ứng oxi hóa – khử.
: không có nguyên tử nguyên tố nào thay đổi số oxi hóa ® không phải là phản ứng oxi hóa – khử.
![]() : không có nguyên tử nguyên tố nào thay đổi số oxi hóa ® không phải là phản ứng oxi hóa – khử.
: không có nguyên tử nguyên tố nào thay đổi số oxi hóa ® không phải là phản ứng oxi hóa – khử.
![]() : không có nguyên tử nguyên tố nào thay đổi số oxi hóa ® không phải là phản ứng oxi hóa – khử.
: không có nguyên tử nguyên tố nào thay đổi số oxi hóa ® không phải là phản ứng oxi hóa – khử.
Câu 14. Cho phương trình hóa học của phản ứng:
aFe + bHNO3 cFe(NO3)3 + dNO + eH2O (a, b, c, d, e là các số nguyên)
Tổng hệ số của các chất trong phương trình hóa học trên là
A. 5.
B. 9.
C. 12.
D. 15.
Đáp án: B
Giải thích:
Phương trình hóa học: a![]() + b
+ b![]() ® c
® c![]() + d
+ d![]() + eH2O.
+ eH2O.
Biểu diễn quá trình oxi hóa, quá trình khử:
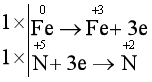
Đặt hệ số của chất oxi hóa và chất khử vào sơ đồ phản ứng, từ đó tính ra hệ số của các chất khác có mặt trong phương trình hóa học. Kiểm tra sự cân bằng số nguyên tử của các nguyên tố ở hai vế.
Fe + 4HNO3 Fe(NO3)3 + NO + 2H2O
Tổng hệ số của các chất trong phương trình hóa học trên là:
a + b + c + d + e = 1 + 4 + 1 + 1 + 2 = 9.
Câu 15. Xét phản ứng: 4NH3 + 5O2 4NO + 6H2O. Cần trộn 1 thể tích khí ammonia với bao nhiêu thể tích không khí để thực hiện phản ứng trên? Biết không khí chứa 21% thể tích oxygen và các thể tích khí đo ở cùng điều kiện về nhiệt độ và áp suất.
A. 4,378.
B. 6,250.
C. 5,952.
D. 1,250.
Đáp án: C
Giải thích:
Phương trình hóa học: 4NH3 + 5O2 4NO + 6H2O.
Theo phương trình hóa học: 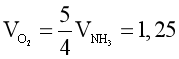 .
.
Không khí chứa 21% thể tích oxygen.
Thể tích không khí là: 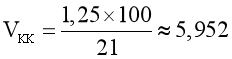 .
.
Bài giảng Hóa học 10 Bài 16: Ôn tập chương 4 - Kết nối tri thức
Xem thêm các bài tóm tắt lý thuyết Hóa học 10 Kết nối tri thức hay, chi tiết khác:
Bài 15: Phản ứng oxi hóa - khử
Bài 17: Biến thiên enthalpy trong các phản ứng hóa học