Tài liệu Bộ đề thi Hoá học lớp 12 Giữa học kì 2 có đáp án năm học 2022 - 2023 gồm 05 đề thi tổng hợp từ đề thi môn Hoá học 12 của các trường THCS trên cả nước đã được biên soạn đáp án chi tiết giúp học sinh ôn luyện để đạt điểm cao trong bài thi Giữa học kì 2 Hoá học lớp 12. Mời các bạn cùng đón xem:
Phòng Giáo dục và Đào tạo .....
Đề thi Giữa học kì 2
Môn: Hóa Học 12
Thời gian làm bài: 45 phút
(Đề 1)
Cho nguyên tử khối của các nguyên tố: C = 12, H = 1, O = 16, Al = 27, Fe = 56, Cr = 52.
Câu 1: Tìm câu phát biểu đúng?
A. Fe chỉ có tính khử, hợp chất sắt (III) chỉ có tính oxi hoá, hợp chất sắt (II) vừa có tính khử và tính oxi hoá.
B. Fe chỉ có tính khử, hợp chất sắt (III) chỉ có tính oxi hoá, hợp chất sắt (II) chỉ có tính oxi hoá .
C. Fe chỉ có tính khử, hợp chất sắt (III) chỉ có tính oxi hoá, hợp chất sắt (II) chỉ có tính khử.
D. Fe chỉ có tính oxi hoá, hợp chất sắt (III) chỉ có tính oxi hoá, hợp chất sắt (II) chỉ có tính khử.
Câu 2: Nhận định nào sau đây sai về Al?
A. Al có tính khử mạnh nhưng yếu hơn Na và Mg.
B. Al thuộc chu kì 3, nhóm IIIA, ô số 13 trong bảng tuần hoàn.
C. Al dẫn điện, dẫn nhiệt tốt, tốt hơn các kim loại Ag và Cu.
D. Al dễ nhường 3 electron hoá trị nên thường có số oxi hoá +3 trong các hợp chất.
Câu 3: Khi cho nhôm tác dụng với dung dịch HNO3 loãng chỉ tạo ra sản phẩm khử là NH4NO3. Tổng các hệ số là số nguyên tối giản nhất trong phương trình hoá học của phản ứng xảy ra là
A. 74.
B. 58.
C. 76.
D. 68.
Câu 4: Khi cho bột sắt dư vào ddAgNO3, hãy cho biết có những phản ứng nào sau đây xảy ra?
A. Đáp án khác.
B. (1).
C. (1) (4) và (3).
D. (2) và (3).
Câu 5: Thứ tự một số cặp oxi hoá - khử trong dãy điện hoá như sau: Mg2+/Mg; Fe2+/Fe; Cu2+/Cu; Fe3+/Fe2+; Ag+/Ag. Dãy chỉ gồm các chất, ion tác dụng được với ion Fe3+ trong dung dịch là
A. Fe, Cu, Ag+.
B. Mg, Fe2+, Ag.
C. Mg, Cu, Cu2+.
D. Mg, Fe, Cu.
Câu 6: Tính chất vật lí nào sau đây không phải là tính chất vật lí của sắt?
A. Có tính nhiễm từ.
B. Màu trắng xám, dẻo, dễ rèn.
C. Dẫn điện và dẫn nhiệt tốt.
D. Kim loại nặng, khó nóng chảy.
Câu 7: Cho 6,72 gam Fe vào 400 ml dung dịch HNO3 1M, đến khi phản ứng xảy ra hoàn toàn, thu được khí NO (sản phẩm khử duy nhất) và dung dịch X. Dung dịch X có thể hoà tan tối đa m gam Cu. Giá trị của m là
A. 0,64.
B. 3,20.
C. 1,92.
D. 3,84.
Câu 8: Cho 9g hợp kim Al tác dụng với dung dịch NaOH đặc, nóng, dư thu được 10,08 lít H2 (đktc). % Al trong hợp kim là
A. 90%.
B. 9%.
C. 7,3%.
D. 73%.
Câu 9: Dãy chất nào sau đây phản ứng với cả 2 dung dịch HCl và KOH?
A. Cr2O3, ZnO, Cr(OH)3.
B. ZnO, CrO3, Cr(OH)2.
C. ZnO, CrO3, Cr(OH)3.
D. ZnO, Cr2O3, Cr(OH)2.
Câu 10: Khối lượng K2Cr2O7 tác dụng vừa đủ với 0,6 mol FeSO4 trong môi trường H2SO4 loãng là:
A. 28,4 gam.
B. 29,4 gam.
C. 27,4 gam.
D. 26,4 gam.
Câu 1 (3 điểm): Viết các PTHH xảy ra trong các trường hợp sau:
a/ Al tác dụng với HCl
b/ Al2O3 tác dụng với KOH
c/ Fe tác dụng với lưu huỳnh
d/ FeO tác dụng với HNO3 loãng
e/ Nhúng dây đồng vào dd FeCl3
f/ Cr tác dụng với HCl nóng
Câu 2 (2 điểm): Cho một lượng hỗn hợp Al, Fe tác dụng với dung dịch H2SO4 loãng, dư thấy thu được 8,96 lít khí ở đktc. Mặt khác, cho lượng hỗn hợp như trên tác dụng với dung dịch NaOH dư thì thu được 6,72 lít khí H2 ở đktc. Tính % khối lượng mỗi kim loại trong hỗn hợp ban đầu.
Câu 3 (2 điểm): Nung m gam Fe trong bình kín chứa V lít không khí (ở đktc; %V của N2 = 80% còn lại là O2) đến khi oxi phản ứng hết thu được 14,08 gam chất rắn X gồm: Fe và 3 oxit của Fe. Hòa tan toàn bộ X bằng một lượng vừa đủ 42 gam dung dịch H2SO4 98% thu được dung dịch Y (sản phẩm khử duy nhất của S+6 là S+4).
a/ Xác định m, V.
b/ Cho 150 ml H2SO4 1M vào Y thu được dung dịch Z. Z hòa tan tối đa a gam Fe. Xác định a.

| Câu | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Đ/a | A | C | B | B | D | D | C | A | A | B |
Câu 1: Phát biểu đúng : Fe chỉ có tính khử, hợp chất sắt (III) chỉ có tính oxi hoá, hợp chất sắt (II) vừa có tính khử và tính oxi hoá. Chọn đáp án A.
Câu 2: Nhận định sai về Al: Al dẫn điện, dẫn nhiệt tốt, tốt hơn các kim loại Ag và Cu.Chọn đáp án C.
Câu 3: 8Al + 30HNO3 → 8Al(NO3)3 + 3NH4NO3 + 9H2O
Tổng các hệ số là số nguyên tối giản nhất trong phương trình hoá học là 58. Chọn đáp án B.
Câu 4: Khi cho bột sắt dư vào ddAgNO3, phản ứng xảy ra: 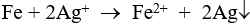
Câu 5: Mg, Fe, Cu tác dụng được với ion Fe3+ trong dung dịch. Chọn đáp án D.
Câu 6: Tính chất vật lí không phải là tính chất vật lí của sắt: “Kim loại nặng, khó nóng chảy”. Chọn đáp án D.
Câu 7:

→ mCu bị hòa tan là 0,03 x 64 = 1,92 g. Chọn đáp án C.
Câu 8: Bảo toàn e có nAl = 0,3 mol → mAl = 0,3.27 = 8,1g.
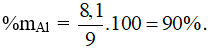
Câu 9: Cr2O3, ZnO, Cr(OH)3 phản ứng với cả 2 dung dịch HCl và KOH. Chọn đáp án A.
Câu 10: Bảo toàn e tính được nK2Cr2O7 = 0,1 mol → m = 0,1. 294 = 29,4 gam. Chọn đáp án B.
Câu 1 (3 điểm): HS viết đúng mỗi PTHH 0,5 điểm, thiếu cân bằng trừ ½ số điểm mỗi PT.
Câu 2 (2 điểm): Gọi số mol Al và Fe trong hỗn hợp lần lượt là x và y (mol)
Câu 3 (2 điểm): a/ Qui đổi hỗn hợp X thành: Fe và O2 với số mol lần lượt là x và y mol
Ta có các quá trình:
Tính số mol H2SO4 = 0,42 mol
Áp dụng định luật bảo toàn e được:
3x = 4y + 2.(0,42 - 1,5x) (I)
Theo bài ra ta có: 56x + 32y = 14,08 (II)
Giải hệ: x = 0,2; y = 0,09
Vậy m = 0,2.56= 11,2 gam; V = 0,09.5.22,4 = 10,08 lít
b/ Z gồm: H2SO4 0,15 mol và Fe2(SO4)3 0,1 mol
Tính được a = 0,25.56 = 14 gam.
Chú ý: HS làm theo cách khác đúng vẫn cho điểm tối đa.
…………………………….Hết……………………………
Phòng Giáo dục và Đào tạo .....
Đề thi Giữa học kì 2
Môn: Hóa Học 12
Thời gian làm bài: 45 phút
(Đề 2)
Cho nguyên tử khối của các nguyên tố: C = 12, H = 1, O = 16, K = 39, Al = 27, Fe = 56, Cu = 64.
Câu 1: X3+ có cấu hình electron là: 1s22s22p63s23p63d5. Cấu hình electron của X2+ là
A. 1s22s22p63s23p64s23d3.
B. 1s22s22p63s23p63d5.
C. 1s22s22p63s23p63d6.
D. 1s22s22p63s23p63d64s2.
Câu 2: Cho từ từ dung dịch NH3 đến dư vào dung dịch AlCl3. Hiện tượng quan sát được là
A. có kết tủa keo trắng tan dần đến hết.
B. có kết tủa keo trắng, không thấy kết tủa tan.
C. có kết tủa keo trắng rồi tan, sau đó lại có kết tủa.
D. dung dịch trong suốt.
Câu 3: Trong quá trình điện phân nóng chảy Al2O3 để sản xuất Al, criolit (3NaF, AlF3) có tác dụng
(1) Tạo hỗn hợp dẫn điện tốt hơn
(2) Hạ nhiệt độ nóng chảy Al2O3
(3) Hạn chế Al sinh ra bị oxi hóa bởi không khí
Số tác dụng đúng là
A. 0.
B. 1.
C. 2.
D. 3.
Câu 4: Hoà tan Fe vào dd AgNO3 dư, dung dịch thu được chứa chất nào sau đây?
A. Fe(NO3)2.
B. Fe(NO3)3.
C. Fe(NO2)2, Fe(NO3)3, AgNO3.
D. Fe(NO3)3, AgNO3.
Câu 5: Hợp chất không có tính lưỡng tính?
A. Al(OH)3.
B. Al2O3.
C. Al2(SO4)3.
D. NaHCO3.
Câu 6: Cho vào dung dịch AlCl3 một lượng Na từ từ đến dư. Sau phản ứng có hiện tượng là
A. Na tan dần, Al kết tủa.
B. Na tan dần, có khí thoát ra và kết tủa xuất hiện.
C. Na tan dần, có khí thoát ra và kết tủa xuất hiện, sau đó kết tủa tan dần.
D. Na tan dần, dung dịch trong suốt rồi lại có kết tủa.
Câu 7: Cho hỗn hợp X gồm Mg và Fe vào dung dịch axit H2SO4 đặc, nóng đến khi các phản ứng xảy ra hoàn toàn, thu được dung dịch Y và một phần Fe không tan. Chất tan có trong dung dịch Y là
A. MgSO4 và FeSO4.
B. MgSO4.
C. MgSO4 và Fe2(SO4)3.
D. MgSO4, Fe2(SO4)3 và FeSO4.
Câu 8: Các thí nghiệm sau:
1. Cho dung dịch AlCl3 tác dụng với dung dịch NH3 dư.
2. Cho dung dịch Ba(OH)2 dư vào dung dịch Al2(SO4)3.
3. Cho dung dịch HCl dư vào dung dịch NaAlO2.
4. Dẫn khí CO2 dư vào dung dịch NaAlO2.
Số thí nghiệm không thu được kết tủa là
A. 0.
B. 2.
C. 1.
D. 3.
Câu 9: Quặng giàu sắt nhất trong tự nhiên nhưng hiếm là
A. Hematit.
B. Xiđehit.
C. Manhetit.
D. Pirit.
Câu 10: Để điều chế Fe(NO3)2 ta có thể dùng phản ứng nào sau đây?
A. Fe + HNO3.
B. Dung dịch Fe(NO3)3 + Fe.
C. FeO + HNO3.
D. FeS + HNO3.
Câu 1 (3 điểm): Viết các PTHH xảy ra trong các trường hợp sau:
a/ Al tác dụng với Cl2
b/ Al tác dụng với H2SO4 đặc, nóng e/ FeO tác dụng với CO
c/ NaOH tác dụng với Al(OH)3
d/ Fe tác dụng với CuSO4
f/ Sục Cl2 vào FeCl2
Câu 2 (2 điểm): Chia hỗn hợp X gồm K, Al và Fe thành hai phần bằng nhau.
- Cho phần 1 vào dung dịch KOH (dư) thu được 0,784 lít khí H2 (đktc).
- Cho phần 2 vào một lượng dư H2O, thu được 0,448 lít khí H2 (đktc) và m gam hỗn hợp kim loại Y. Hoà tan hoàn toàn Y vào dung dịch HCl (dư) thu được 0,56 lít khí H2 (đktc). Tính khối lượng mỗi kim loại trong mỗi phần.
Câu 3 (2 điểm): Cho 36 gam hỗn hợp Fe, FeO, Fe3O4 tác dụng hoàn toàn với dung dịch H2SO4 đặc, nóng dư thấy thoát ra 5,6 lít khí SO2 ở đktc (sản phẩm khử duy nhất).Tính số mol H2SO4 đã phản ứng.
| Câu | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Đ/a | C | B | D | D | C | C | A | B | C | B |
Câu 1: Cấu hình electron của X2+ là 1s22s22p63s23p63d6. Chọn đáp án C.
Câu 2: AlCl3 + 3NH3 + 3H2O → Al(OH)3↓ + 3NH4Cl. Chọn đáp án B.
Câu 3: Trong quá trình điện phân nóng chảy Al2O3 để sản xuất Al, criolit (3NaF, AlF3) có tác dụng
(1) Tạo hỗn hợp dẫn điện tốt hơn
(2) Hạ nhiệt độ nóng chảy Al2O3
(3) Hạn chế Al sinh ra bị oxi hóa bởi không khí. Chọn đáp án D.
Câu 4: Fe + 2Ag+ → Fe2+ + 2Ag
Fe2+ + Ag+ → Fe3+ + Ag
Dung dịch sau phản ứng gồm: Fe(NO3)3 và AgNO3 dư. Chọn đáp án D.
Câu 5: Al2(SO4)3 không có tính lưỡng tính. Chọn đáp án C.
Câu 6: 2Na + 2H2O → 2NaOH + H2↑
AlCl3 + 3NaOH → Al(OH)3↓ + 3NaCl
Al(OH)3 + NaOH dư → NaAlO2 + H2O
Chọn đáp án C.
Câu 7: Sau phản ứng còn Fe dư, chất tan có trong dung dịch Y là MgSO4 và FeSO4. Chọn đáp án A.
Câu 8: Thí nghiệm không thu được kết tủa là:
2. Cho dung dịch Ba(OH)2 dư vào dung dịch Al2(SO4)3.
3. Cho dung dịch HCl dư vào dung dịch NaAlO2.
Chọn đáp án B.
Câu 9: Quặng giàu sắt nhất trong tự nhiên nhưng hiếm là manhetit. Chọn đáp án C.
Câu 10: Fe + 2Fe(NO3)3 → 3Fe(NO3)2. Chọn đáp án B.
Câu 1 (3 điểm): HS viết đúng mỗi PTHH 0,5 điểm, thiếu cân bằng trừ ½ số điểm mỗi PT.
Câu 2 (2 điểm): Gọi số mol K, Al, Fe trong mỗi phần lần lượt là x, y, z (mol)
Câu 3 (2 điểm): Quy đổi hỗn hợp: Fe, FeO, Fe3O4 thành Fe (x mol) và O ( y mol)
Chú ý: HS làm theo cách khác đúng vẫn cho điểm tối đa.
…………………………….Hết……………………………
Phòng Giáo dục và Đào tạo .....
Đề thi Giữa học kì 2
Môn: Hóa Học 12
Thời gian làm bài: 45 phút
(Đề 3)
Cho nguyên tử khối của các nguyên tố: C = 12, H = 1, O = 16, Fe = 56, Cr = 52, Mg = 24, Al = 27.
Câu 1: Hỗn hợp X gồm Al, Fe2O3, Cu có số mol bằng nhau. Hỗn hợp X tan hoàn toàn trong
A. AgNO3 dư.
B. NH3 dư.
C. NaOH dư.
D. HCl dư.
Câu 2: Chọn câu đúng ?
A. Khi thêm dung dịch bazơ vào muối cromat màu vàng sẽ tạo thành đicromat có màu da cam.
B. Khi thêm dung dịch axit vào muối cromat màu vàng sẽ tạo thành đicromat có màu da cam.
C. Khi thêm dung dịch axit vào muối cromat màu da cam sẽ tạo thành đicromat có màu vàng.
D. Khi thêm dung dịch bazơ vào muối cromat màu da cam sẽ tạo thành đicromat có màu vàng.
Câu 3: Cation M3+ có cấu hình electron ở lớp ngoài cùng là 2s22p6. Vị trí M trong bảng tuần hoàn là
A. ô 13, chu kì 3, nhóm IIIA.
B. ô 13, chu kì 3, nhóm IIIB.
C. ô 13, chu kì 3, nhóm IA.
D. ô 13, chu kì 3, nhóm IB.
Câu 4: Có các kim loại Cu, Ag, Fe và các dung dịch muối Cu(NO3)2, Fe(NO3)3, AgNO3 . Kim loại nào tác dụng được với cả 3 dung dịch muối?
A. Cu.
B. Ag .
C. Fe.
D. Cu, Fe.
Câu 5: Chọn câu không đúng
A. Nhôm là kim loại nhẹ, dẫn điện, dẫn nhiệt tốt.
B. Nhôm có tính khử mạnh chỉ sau kim loại kiềm và kiềm thổ.
C. Nhôm bị phá hủy trong môi trường kiềm.
D. Nhôm là kim loại lưỡng tính.
Câu 6: Quặng nhôm (nguyên liệu chính) được dùng trong sản xuất nhôm là
A. Boxit Al2O3.2H2O.
B. Criolit Na3AlF6 (hay 3NaF.AlF3).
C. Aluminosilicat (Kaolin) Al2O3.2SiO2.2H2O.
D. Mica K2O.Al2O3.6SiO2.2H2O.
Câu 7: Cần bao nhiêu tấn quặng manhetit chứa 80% Fe3O4 để có thể luyện được 800 tấn gang có hàm lượng 95%. Lượng Fe hao hụt trong sản xuất là 1%.
A. 2351,16 tấn.
B. 3512,61 tấn.
C. 1325,16 tấn.
D. 5213,61 tấn.
Câu 8: Cho 5,2 gam Cr tác dụng với HNO3 loãng dư, thu được V lít khí NO (sản phẩm khử duy nhất ở đktc). V có giá trị là
A. 3,36.
B. 6,72.
C. 4,48.
D. 2,24.
Câu 9: Hoà tan hoàn toàn 1,28 gam hỗn hợp Fe và Mg trong lượng dư dung dịch HNO3 thấy thoát ra 0,03 mol khí NO duy nhất (đktc). Số mol Fe và Mg trong hỗn hợp lần lượt là
A. 0,01 mol và 0,03 mol.
B. 0,02 mol và 0,03 mol.
C. 0,03 mol và 0,02 mol.
D. 0,03 mol và 0,03 mol.
Câu 10: Đốt Fe trong khí clo thiếu thu được hỗn hợp gồm 2 chất rắn. Hãy cho biết thành phần của chất rắn đó:
A. FeCl3 và Fe.
B. FeCl2 và Fe.
C. Fe, FeCl2, FeCl3.
D. FeCl2 và FeCl3.
Câu 1 (3 điểm): Viết các PTHH xảy ra trong sơ đồ sau:
Câu 2 (2 điểm): Trộn 10,8 gam bột Al với 34,8 gam bột Fe3O4 rồi tiến hành phản ứng nhiệt nhôm trong điều kiện không có không khí. Hoà tan hoàn toàn hỗn hợp rắn sau phản ứng bằng dung dịch H2SO4 loãng (dư), thu được 10,752 lít khí H2 (đktc). Tính hiệu suất của phản ứng nhiệt nhôm.
Câu 3 (2 điểm): Cho 4,48 lít khí CO (ở đktc) từ từ đi qua ống sứ đựng 8 gam một oxit sắt đến khi phản ứng xảy ra hoàn toàn. Khí thu được sau phản ứng có tỉ khối so với hiđro bằng 20. Xác định công thức của oxit sắt và phần trăm thể tích của khí CO2 trong hỗn hợp khí sau phản ứng.

| Câu | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Đ/a | D | B | A | C | D | A | C | D | A | A |
Câu 1:
Chọn đáp án D.
Câu 2: Khi thêm dung dịch axit vào muối cromat màu vàng sẽ tạo thành đicromat có màu da cam. Chọn đáp án B.
Câu 3: M: 1s22s22p63s23p1. Vị trí M trong bảng tuần hoàn là ô 13, chu kì 3, nhóm IIIA. Chọn đáp án A.
Câu 4: Fe tác dụng được với cả 3 dung dịch muối Cu(NO3)2, Fe(NO3)3, AgNO3. Chọn đáp án C.
Câu 5: Câu không đúng: Nhôm là kim loại lưỡng tính. Chọn đáp án D.
Câu 6: Quặng nhôm (nguyên liệu chính) được dùng trong sản xuất nhôm là Boxit Al2O3.2H2O. Chọn đáp án A.
Câu 7: Ta có sơ đồ:
Fe3O4 → 3Fe
232g → 3.56g
x tấn → 800.95% tấn
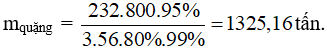
Câu 8: Bảo toàn e: nNO = nCr = 0,1 → V = 2,24 lít. Chọn đáp án D.
Câu 9: Gọi số mol Fe và Mg lần lượt là x và y mol.
Theo bài ra có hệ:
Giải hệ được: x = 0,01 và y = 0,03. Chọn đáp án A.
Câu 10: 2Fe + 3Cl2 → 2FeCl3. Hai chất rắn là FeCl3 và Fe dư. Chọn đáp án A.
Câu 1 (3 điểm): HS viết đúng mỗi PTHH 0,5 điểm, thiếu cân bằng trừ ½ số điểm mỗi PT
Câu 2 (2 điểm): Tính được: nAl = 0,4 mol, nFe3O4 = 0,15 mol, nH2 = 0,48 mol
Hỗn hợp chất rắn sau phản ứng gồm: Al2O3, Fe, Al dư, Fe3O4 dư
Gọi số mol Al phản ứng là x → số mol Fe = 1,125 mol
Bảo toàn e: (0,4 – x).3 + 1,125x.2 = 0,48.2 → x = 0,32
Giả sử H = 100% → Cả hai chất tham gia phản ứng đều hết
Câu 3 (2 điểm):
Hỗn hợp khí sau phản ứng gồm CO (x mol) và CO2 (y mol)
nhh khí = nCO + nCO2 = nCO bđ → x + y = 0,2 (1)
mhh khí = 20.2.0,2 = 8 gam → 28x + 44y = 8 (2)
Giải hệ được x = 0,05 và y = 0,15 → %VCO2 = 75%.
nCO2 = nO(oxit sắt) = 0,15 mol
mFe(oxit) 8 – 0,15.16 = 5,6 gam → nFe(oxit) = 0,1 mol
Đặt oxit: FexOy → x : y = 0,1 : 0,15 = 2 : 3
Vậy oxit sắt là Fe2O3.
Chú ý: HS làm theo cách khác đúng vẫn cho điểm tối đa.
…………………………….Hết……………………………
Phòng Giáo dục và Đào tạo .....
Đề thi Giữa học kì 2
Môn: Hóa Học 12
Thời gian làm bài: 45 phút
(Đề 4)
Cho nguyên tử khối của các nguyên tố: C = 12, H = 1, O = 16, Al = 27, Fe = 56.
Câu 1: Phản ứng hóa học nào không xảy ra khi thực hiện quá trình luyện gang trong lò cao?
A. C + O2 → CO2.
B. C + 2O2 → 2CO.
C. 2C + O2 → 2CO.
D. Cả A và C.
Câu 2: Phát biểu nào dưới đây là đúng?
A. Nhôm là một kim loại lưỡng tính.
B. Al2O3 là một oxit trung tính.
C. Al(OH)3 là một bazơ lưỡng tính.
D. Al(OH)3 là một hiđroxit lưỡng tính.
Câu 3: Tính chất nào sau đây là tính chất chung của các hợp chất: FeO, Fe2O3, Fe(OH)2, Fe(OH)3?
A. Tính khử.
B. Tính oxi hoá.
C. Tính bazơ
D. Tính axit.
Câu 4: Cho 32,04 gam AlCl3 vào 500 ml dung dịch NaOH 1,6M sau khi phản ứng xong thu được thu được bao nhiêu gam kết tủa?
A. 12,48 gam.
B. 4,68 gam.
C. 18,72gam.
D. 6,24 gam.
Câu 5: Nhôm không tan trong dung dịch nào dưới đây?
A. HCl.
B. H2SO4.
C. KHSO4.
D. NH3.
Câu 6: Quặng manđehit chứa
A. Fe2O2.
B. Fe2O3.nH2O.
C. Fe3O4.
D. FeCO3.
Câu 7: Crom không tan được trong dung dịch
A. H2SO4 đặc, nguội.
B. HBr đặc, nguội.
C. HCl đặc.
D. HNO3 đặc, nóng.
Câu 8: Biết cấu hình của Fe là: 1s22s22p63s23p63d64s2. Vị trí của Fe trong bảng tuần hoàn là
A. Ô: 26, chu kì: 4, nhóm VIIIB.
B. Ô: 25, chu kì: 3, nhóm IIB.
C. Ô: 26, chu kì: 4, nhóm IIA.
D. Ô: 20, chu kì: 3, nhóm VIIIA.
Câu 9: Các số oxi hoá đặc trưng của Crom trong hợp chất là
A. +1, +2, +4, +6.
B. +3, +4, +6.
C. +2, +4, +6.
D. +2, + 3, +6.
Câu 10: Khử hoàn toàn 16g bột oxit sắt nguyên chất bằng CO ở nhiệt độ cao. Sau khi phản ứng kết thúc, khối lượng chất rắn giảm 4,8g. Oxit sắt đã dùng là
A. Fe2O
B. Fe2O3
C. FeO
D. Fe3O4
Câu 1 (3 điểm): Hoàn thiện các PTHH xảy ra trong sơ đồ sau:
Câu 2 (2 điểm): Cho 1,56 gam hỗn hợp gồm Al và Al2O3 phản ứng hết với dung dịch HCl (dư), thu được V lít khí H2 (đktc) và dung dịch X. Nhỏ từ từ dung dịch NH3 đến dư vào dung dịch X thu được kết tủa, lọc hết lượng kết tủa, nung đến khối lượng không đổi thu được 2,04 gam chất rắn. Viết các PTHH xảy ra và tính giá trị của V.
Câu 3 (2 điểm): Nung nóng m gam hỗn hợp Al và Fe2O3 (trong môi trường không có không khí) đến khi phản ứng xảy ra hoàn toàn, thu được hỗn hợp rắn Y. Chia Y thành hai phần bằng nhau:
- Phần 1 tác dụng với dung dịch H2SO4 loãng (dư), sinh ra 3,08 lít khí H2 (ở đktc);
- Phần 2 tác dụng với dung dịch NaOH (dư), sinh ra 0,84 lít khí H2 (ở đktc).
Tính giá trị của m.
| Câu | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Đ/a | C | D | C | A | D | C | A | A | D | B |
Câu 1: Phản ứng hóa học không xảy ra khi thực hiện quá trình luyện gang trong lò cao:
2C + O2 → 2CO. Chọn đáp án C.
Câu 2: Phát biểu đúng : Al(OH)3 là một hiđroxit lưỡng tính. Chọn đáp án D.
Câu 3: Các hợp chất: FeO, Fe2O3, Fe(OH)2, Fe(OH)3 đều có tính bazơ. Chọn đáp án C.
Câu 4:
→ n↓ = 0,16 → m↓ = 0,16.78 = 12,48 gam. Chọn đáp án A.
Câu 5: Nhôm không tan trong dung dịch NH3. Chọn đáp án D.
Câu 6: Quặng manđehit chứa Fe3O4. Chọn đáp án C.
Câu 7: Crom không tan được trong dung dịch H2SO4 đặc, nguội. Chọn đáp án A.
Câu 8: Vị trí của Fe trong bảng tuần hoàn là Ô: 26, chu kì: 4, nhóm VIIIB. Chọn đáp án A.
Câu 9: Các số oxi hoá đặc trưng của Crom trong hợp chất là +2, + 3, +6. Chọn đáp án D.
Câu 10: mcr ↓ = mO (oxit) → nO (oxit) = 4,8 : 16 = 0,3 mol.
mFe (oxit) = 16 – 4,8 = 11,2 → nFe (oxit) = 11,2 : 56 = 0,2 mol
Đặt oxit: FexOy có: x : y = nFe (oxit) : nO (oxit) = 2 : 3. Vậy oxit là Fe2O3. Chọn đáp án B.
Câu 1 (3 điểm): HS viết đúng mỗi PT 0,5 điểm, thiếu cân bằng trừ ½ số điểm mỗi PT.
Câu 2 (2 điểm):
Gọi số mol Al, Al2O3 trong hỗn hợp ban đầu lần lượt là a và b (mol)
→ 27a + 102b = 1,56 (1)
Kết tủa sau khi nung là Al2O3: 0,02 mol → 0,5a + b = 0,02 (2)
Từ (1) và (2) → a = 0,02 và b = 0,01
→ nkhí = 0,03 mol → Vkhí = 0,03.22,4 = 6,72 lít.
Câu 3 (2 điểm):
Theo bài ra Y gồm: Al2O3, Fe, Al dư
Gọi số mol Al2O3, Fe, Al dư trong mỗi phần lần lượt là x, y, z (mol)
→ y = 2x → 2x – y = 0 (1)
Phần 1:
Bảo toàn e: 2y + 3z = 0,275 (2)
Phần 2:
Bảo toàn e: 3z = 0,075 (3)
Giải hệ được: x = 0,05; y = 0,1; z = 0,025
Bảo toàn khối lượng: m = mY = 2.(0,05.102 + 0,1.56 + 0,025.27) = 22,75 gam.
Chú ý: HS làm theo cách khác đúng vẫn cho điểm tối đa.
…………………………….Hết……………………………
Phòng Giáo dục và Đào tạo .....
Đề thi Giữa học kì 2
Môn: Hóa Học 12
Thời gian làm bài: 45 phút
(Đề 5)
Cho nguyên tử khối của các nguyên tố: C = 12, H = 1, O = 16, Fe = 56, Al = 27, S = 32.
Câu 1: Cho sơ đồ phản ứng sau: chất X + H2SO4 → FeSO4 + SO2 + H2O. Hãy cho biết, chất X có thể là chất nào trong số các chất sau?
A. FeSO3.
B. FeS.
C. Fe.
D. Tất cả đều thoả mãn.
Câu 2: Cấu hình electron của ion Cr3+ là
A. [Ar]3d5.
B. [Ar]3d4.
C. [Ar]3d2.
D. [Ar]3d3.
Câu 3: Thuốc thử duy nhất để nhận biết các dung dịch: FeCl2, FeCl3, CrCl3, CuCl2 là
A. Dung dịch H2SO4 loãng.
B. Quỳ tím.
C. Dung dịch Ba(OH)2 dư.
D. Dung dịch HCl.
Câu 4: Khi đốt Fe với bột lưu huỳnh trong điều kiện không có oxi thu được chất X. Hãy cho biết công thức của X.
A. FeS.
B. FeS2.
C. Fe2S3.
D. Cả hỗn hợp 3 chất.
Câu 5: Cho 5,4 gam bột nhôm vào dung dịch HNO3 loãng 1M, nóng, vừa đủ không thấy có khí thoát ra. Thể tích HNO3 đã dùng là
A. 750 ml.
B. 250 ml.
C. 200 ml.
D. 400 ml.
Câu 6: Crom không tan được trong dung dịch
A. H2SO4 đặc, nguội.
B. HBr đặc, nguội.
C. HCl đặc.
D. HNO3 đặc, nóng.
Câu 7: Ion Al3+ bị khử trong trường hợp nào sau đây?
A. Điện phân Al2O3 nóng chảy.
B. Điện phân dd AlCl3 với điện cực trơ có màng ngăn.
C. Dùng H2 khử Al2O3 ở nhiệt độ cao.
D. Thả Na vào dung dịch Al2(SO4)3.
Câu 8: Hoà tan 5,6 gam Fe bằng dung dịch H2SO4 loãng (dư), thu được dung dịch X. Dung dịch X phản ứng vừa đủ với V ml dung dịch KMnO4 0,5M. Giá trị của V là
A. 20.
B. 80.
C. 60.
D. 40.
Câu 9: Phản ứng nào sau đây không đúng?
A. 2FeO + 4H2SO4 → Fe2(SO4)3 + SO2 + 4H2O.
B. Fe3O4 + 4H2SO4 → Fe2(SO4)3 + 4H2O.
C. 2Fe + 6H2SO4 → Fe2(SO4)3 + 3SO2 + 6H2O.
D. 6FeCl2 + 3Br2 → 2FeBr3 + 4FeCl3.
Câu 10: Hoà tan hoàn toàn 2,81 gam hỗn hợp gồm Fe2O3, MgO, ZnO trong 500 ml axit H2SO4 0,1M (vừa đủ). Sau phản ứng, hỗn hợp muối sunfat khan thu được khi cô cạn dung dịch có khối lượng là
A. 5,81 gam.
B. 6,81 gam.
C. 4,81 gam.
D. 3,81 gam.
Câu 1 (3 điểm): Viết các PTHH xảy ra trong sơ đồ sau:
Câu 2 (2 điểm): Cho 42,4 gam hỗn hợp gồm Cu và Fe3O4 (có tỉ lệ số mol tương ứng là 3 : 1) tác dụng với dung dịch HCl dư, sau khi các phản ứng xảy ra hoàn toàn còn lại m gam chất rắn. Viết các PTHH xảy ra và Tính giá trị của m.
Câu 3 (2 điểm): Cho V lít dung dịch NaOH 2M vào dung dịch chứa 0,1 mol Al2(SO4)3 và 0,1 mol H2SO4 đến khi phản ứng hoàn toàn, thu được 7,8 gam kết tủa. Tính giá trị lớn nhất của V để thu được lượng kết tủa trên.
| Câu | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Đ/a | A | D | C | A | A | A | A | D | B | B |
Câu 1: FeSO3 + H2SO4 → FeSO4 + SO2 + H2O. Chọn đáp án A.
Câu 2: Cấu hình electron của ion Cr3+ là [Ar]3d3. Chọn đáp án D.
v
Câu 3: Dùng Ba(OH)2 dư, hiện tượng:
+ Kết tủa trắng hơi xanh bị hóa nâu đỏ trong không khí → FeCl2
+ Kết tủa nâu đỏ → FeCl3
+ Kết tủa xanh → CuCl2
+ Tạo kết tủa sau đó kết tủa tan trong Ba(OH)2 dư → CrCl3. Chọn đáp án C.
Câu 4: 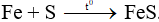
Câu 5:
→ V = 0,75 : 1 = 0,75 lít = 750 ml. Chọn đáp án A.
Câu 6: Crom không tan được trong dung dịch H2SO4 đặc, nguội. Chọn đáp án A.
Câu 7: Ion Al3+ bị khử trong trường hợp điện phân Al2O3 nóng chảy. Chọn đáp án A.
Câu 8: Bảo toàn e có nKMnO4 = 0,1 : 5 = 0,02 mol → V = 0,02 : 0,5 = 0,04 lít = 40 ml.
Chọn đáp án D.
Câu 9: Phản ứng không đúng: Fe3O4 + 4H2SO4 → Fe2(SO4)3 + 4H2O. Chọn đáp án B.
Câu 10: nO (oxit) = naxit = ngốc axit = 0,05 mol
mkl (oxit) = 2,81 – 0,05.16 = 2,01 gam.
mmuối = mkl (oxit) + mgốc axit = 2,01 + 0,05.96 = 6,81 gam. Chọn đáp án B.
Câu 1 (3 điểm): HS viết đúng mỗi PTHH 0,5 điểm, thiếu cân bằng trừ ½ số điểm mỗi PT
Câu 2 (2 điểm): Gọi số mol Fe3O4 là a → số mol Cu là 3a (mol)
→ 232a + 64.3a = 42,4 → a = 0,1 mol
nCu dư = 0,3 – 0,1 = 0,2 → mCu = 0,2.64 = 12,8 gam
Câu 3 (2 điểm): Tính được n↓ = 0,1 mol
Để V là lớn nhất thì sau khi tạo kết tủa, kết tủa tan một phần.
→ nNaOH = 0,2 + 0,6 + 0,1 = 0,9 mol
V = 0,9 : 2 = 0,45 lít.
Chú ý: HS làm theo cách khác đúng vẫn cho điểm tối đa.
…………………………….Hết……………………………