Tài liệu Bộ đề thi Hoá học lớp 12 Giữa học kì 2 có đáp án năm học 2024 - 2025 gồm 05 đề thi tổng hợp từ đề thi môn Hoá học 12 của các trường THCS trên cả nước đã được biên soạn đáp án chi tiết giúp học sinh ôn luyện để đạt điểm cao trong bài thi Giữa học kì 2 Hoá học lớp 12. Mời các bạn cùng đón xem:
Chỉ từ 150k mua trọn bộ Đề thi giữa kì 2 Hóa học 12 bản word có lời giải chi tiết:
B1: Gửi phí vào tài khoản 0711000255837 - NGUYEN THANH TUYEN - Ngân hàng Vietcombank
B2: Nhắn tin tới zalo Vietjack Official - nhấn vào đây để thông báo và nhận giáo án.
Xem thử tài liệu tại đây: Link tài liệu
Phòng Giáo dục và Đào tạo .....
Đề thi Giữa học kì 2
Môn: Hóa Học 12
Thời gian làm bài: 45 phút
(Đề 1)
Cho nguyên tử khối của các nguyên tố: C = 12, H = 1, O = 16, Li = 7, Na = 23, K = 39, Rb = 85, Cs = 133, Be = 9, Mg = 24, Ca = 40, Sr = 88, Ba = 137.
Câu 1: Phương pháp điều chế kim loại nhóm IIA là
A. phương pháp thủy luyện.
B. phương pháp điện phân dung dịch.
C. phương pháp điện phân nóng chảy.
D. tất cả các phương pháp trên.
Câu 2: Loại đá và khoáng chất nào sau đây không chứa canxi cacbonat?
A. Đá hoa cương.
B. Thạch cao.
C. Đá phấn.
D. Đá vôi.
Câu 3: Phát biểu nào sau đây là đúng?
(1) Na2CO3 được ứng dụng để sản xuất thủy tinh, bột giặt, ...
(2) NaCl được dùng làm thuốc muối chữa bệnh dạ dày, bột nở.
(3) NaOH được ứng dụng trong chế biến dầu mỏ và sản xuất xà phòng, ...
(4) CaSO4.2H2O được sử dụng làm vật liệu xây dựng, sản xuất: amoniac, clorua vôi, ...
(5) Mg được ứng dụng sản xuất hợp kim nhẹ, chất tạo màu trắng trong pháo hoa, ...
A. (1), (3), (5).
B. (1), (2), (3), (4).
C. (2), (3), (5).
D. (3), (4), (5).
Câu 4: Khi cho kim loại Na vào dung dịch CuSO4 thì sẽ xảy ra hiện tượng nào sau đây?
A. Ban đầu có xuất hiện kết tủa xanh, sau đó kết tủa tan ra, dung dịch trong suốt.
B. Ban đầu có sủi bọt khí, sau đó xuất hiện kết tủa xanh.
C. Ban đầu có sủi bọt khí, sau đó có tạo kết tủa xanh, rồi kết tủa tan ra, dd trong suốt.
D. Chỉ có sủi bọt khí.
Câu 5: Để loại hết Ca2+, Mg2+ ra khỏi dung dịch X gồm: Ca(HCO3)2; Mg(HCO3)2; Na2SO4 không thể dùng chất nào sau đây ở điều kiện thường?
A. Ca(OH)2 vừa đủ.
B. NaOH.
C. BaCl2
D. Na3PO4.
Câu 6: Cho một mẫu hợp kim Na - Ba tác dụng với nước (dư), thu được dung dịch X và 3,36 lít H2 (ở đktc). Thể tích dung dịch axit H2SO4 2M cần dùng để trung hoà dung dịch X là
A. 150ml.
B. 75ml.
C. 60ml.
D. 30ml.
Câu 7: Nhận định nào sau đây về nước cứng là sai ?
A. Nước cứng có chứa nhiều Ca2+; Mg2+.
B. Nước cứng có chứa 1 trong 2 ion Cl- và SO42- hoặc cả 2 là nước cứng tạm thời.
C. Nước không chứa hoặc chứa rất ít ion Ca2+ , Mg2+ là nước mềm.
D. Nước cứng có chứa đồng thời anion HCO3- và SO42- hoặc Cl- là nước cứng toàn phần.
Câu 8: Cho dd chứa 0,3 mol KOH tác dụng với 0,2 mol CO2. Dung dịch sau phản ứng gồm các chất nào sau đây?
A. KOH, K2CO3.
B. KHCO3.
C. K2CO3.
D. KHCO3, K2CO3.
Câu 9: Nung 13,4 gam hỗn hợp 2 muối cacbonat của 2 kim loại hóa trị II, thu được 6,8 gam chất rắn và khí X. Lượng khí X sinh ra cho hấp thụ vào 75 ml dung dịch NaOH 1M, khối lượng muối có trong dung dịch thu được sau phản ứng là
A. 5,8 gam.
B. 6,5 gam.
C. 4,2 gam.
D. 6,3 gam.
Câu 10: Tính chất của kim loại kiềm và kiềm thổ là
A. dễ nhường eletron thể hiện tính oxi hoá.
B. dễ nhường electron thể hiện tính khử.
C. dễ nhận electron thể hiện tính oxi hoá.
D. dễ nhận electron thể hiện tính khử.
Câu 1 (2 điểm): Không dùng chất chỉ thị, hãy phân biệt các dung dịch sau chứa trong bình mất nhãn: CaCl2, NaCl, HCl.
Câu 2 (2 điểm): Cho 3,82 gam hỗn hợp G gồm 2 muối cacbonat của 2 kim loại kiềm (thuộc hai chu kì liên tiếp trong bảng tuần hoàn) vào dung dịch H2SO4 2M dư thu được 1,32 gam khí không màu bay ra. Tính % khối lượng của từng muối trong G.
Câu 3 (2 điểm): Hấp thụ hoàn toàn 3,36 lít khí CO2 (đktc) vào 125 ml dung dịch Ba(OH)2 1M, thu được dung dịch X. Coi thể tích dung dịch không thay đổi, tính nồng độ mol của chất tan trong dung dịch.
Câu 4 (1 điểm): Điện phân dung dịch CuCl2 với điện cực trơ, sau một thời gian thu được 0,32 gam Cu ở catôt và một lượng khí X ở anôt. Hấp thụ hoàn toàn lượng khí X trên vào 200 ml dung dịch NaOH (ở nhiệt độ thường). Sau phản ứng, nồng độ NaOH còn lại là 0,05M (giả thiết thể tích dung dịch không thay đổi). Tính nồng độ ban đầu của dung dịch NaOH.

| Câu | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Đ/a | C | B | A | B | C | B | B | D | D | B |
Câu 1: Phương pháp điều chế kim loại nhóm IIA là phương pháp điện phân nóng chảy. Chọn đáp án C.
Câu 2: Thạch cao không chứa canxi cacbonat. Chọn đáp án B.
Câu 3: Phát biểu đúng là:
(1) Na2CO3 được ứng dụng để sản xuất thủy tinh, bột giặt, ...
(3) NaOH được ứng dụng trong chế biến dầu mỏ và sản xuất xà phòng, ...
(5) Mg được ứng dụng sản xuất hợp kim nhẹ, chất tạo màu trắng trong pháo hoa, ...
Chọn đáp án A.
Câu 4: Khi cho kim loại Na vào dung dịch CuSO4:
2Na + 2H2O → 2NaOH + H2 (↑)
CuSO4 + 2NaOH → Cu(OH)2 (↓ xanh) + Na2SO4. Chọn đáp án B.
Câu 5: Để loại hết Ca2+, Mg2+ ra khỏi dung dịch X gồm: Ca(HCO3)2; Mg(HCO3)2; Na2SO4 không thể dùng BaCl2 ở điều kiện thường. Chọn đáp án C.
Câu 6: nH+ = nOH- = 2nkhí = 0,3 mol → naxit = 0,15 mol → Vaxit = 0,15 : 2 = 75 ml.
Chọn đáp án B.
Câu 7: Nhận định sai là: Nước cứng có chứa 1 trong 2 ion Cl- và SO42- hoặc cả 2 là nước cứng tạm thời. Chọn đáp án B.
Câu 8:
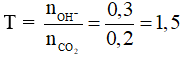
Câu 9:
Bảo toàn khối lượng: mCO2 = 13,4 – 6,8 = 6,6 gam → nCO2 = 0,15.
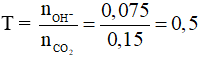
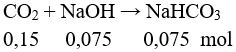
mmuối = 0,075.84 = 6,3 gam. Chọn đáp án D.
Câu 10: Tính chất của kim loại kiềm và kiềm thổ là dễ nhường electron thể hiện tính khử. Chọn đáp án B.
Câu 1 (2điểm): Đánh số thứ tự từng lọ, trích mỗi lọ một ít sang ống nghiệm đánh số tương ứng.
Nhỏ từ từ dd Na2CO3 vào từng mẫu thử.
Có khí bay lên → HCl
2HCl + Na2CO3 → 2NaCl + CO2 ↑ + H2O
Xuất hiện kết tủa trắng → CaCl2
CaCl2 + Na2CO3 → CaCO3 ↓ + 2NaCl
Không hiện tượng → NaCl
Câu 2 (2điểm): Giả sử 2 kim loại là A và B, giả sử MA < MB.
Đặt 2 kim loại tương ứng với 1 KL là R → MA < MR < MB
→ MR2CO3 = 3,82 : 0,03 = 127,33 → MR = 33,67.
Vậy 2 muối là Na2CO3 (x mol) và K2CO3 (y mol)
Giải hệ được x = 0,01 và y = 0,02
→ %mNa2CO3 = 27,75%; %mK2CO3 =72,25%.
Câu 3 (2điểm):
Tính được số mol CO2 = 0,15 mol, số mol OH- = 0,25 mol
Câu 4 (1điểm): Tính được nCu = 0,005 mol, nNaOH dư = 0,05.0,2 = 0,01 mol
nNaOH bđ = 0,01 + 0,01 = 0,02 mol → CM bđ = 0,02 : 0,2 = 0,1M.
Chú ý: HS làm theo cách khác đúng vẫn cho điểm tối đa.
…………………………….Hết……………………………
Phòng Giáo dục và Đào tạo .....
Đề thi Giữa học kì 2
Môn: Hóa Học 12
Thời gian làm bài: 45 phút
(Đề 2)
Cho nguyên tử khối của các nguyên tố: C = 12, H = 1, O = 16, Cu = 64, Be = 9, Mg = 24, Ca = 40, Sr = 88, Ba = 137.
Câu 1: Chất phản ứng được với dung dịch NaOH tạo kết tủa là
A. KNO3.
B. FeCl3.
C. BaCl2.
D. K2SO4.
Câu 2: Phương pháp thích hợp điều chế kim loại Ca từ CaCl2 là
A. nhiệt phân CaCl2.
B. dùng Na khử Ca2+ trong dung dịch CaCl2.
C. điện phân dung dịch CaCl2.
D. điện phân CaCl2 nóng chảy.
Câu 3: Khi hòa tan hoàn toàn m gam mỗi kim loại vào nước dư, từ kim loại nào sau đây thu được thể tích khí H2 (cùng điều kiện nhiệt độ và áp suất) là nhỏ nhất?
A. Na.
B. Ca.
C. K.
D. Li.
Câu 4: Để bảo quản natri, người ta phải ngâm natri trong
A. nước.
B. rượu etylic.
C. dầu hỏa.
D. phenol lỏng.
Câu 5: Phát biểu nào sau đây là sai?
A. Các kim loại kiềm có nhiệt độ nóng chảy tăng dần từ Li đến Cs.
B. Các kim loại kiềm đều là kim loại nhẹ.
C. Các kim loại kiềm có bán kính nguyên tử lớn hơn so với các kim loại cùng chu kì.
D. Các kim loại kiềm có màu trắng bạc và có ánh kim.
Câu 6: Khi dẫn từ từ khí CO2 đến dư vào dung dịch Ca(OH)2 thấy có
A. bọt khí và kết tủa trắng.
B. bọt khí bay ra.
C. kết tủa trắng xuất hiện.
D. kết tủa trắng, sau đó kết tủa tan dần.
Câu 7: Cho 1,2 gam một kim loại thuộc nhóm IIA trong bảng HTTH tác dụng với HCl thu được 0,672 lít khí (đktc). Kim loại đó là
A. Be.
B. Mg.
C. Ca.
D. Ba.
Câu 8: Điện phân 500 ml dung dịch CuSO4 0,1M (điện cực trơ) cho đến khi ở catot thu được 1,6 gam kim loại thì thể tích khí (đktc) thu được ở anot là
A. 2,24 lít.
B. 0,28 lít.
C. 0,56 lít.
D. 1,12 lít.
Câu 9: Nước cứng không gây ra tác hại nào dưới đây?
A. Gây ngộ độc nước uống.
B. Làm mất tính tẩy rửa của xà phòng, làm hư hại quần áo.
C. Làm hỏng các dung dịch pha chế. Làm thực phẩm lâu chín và giảm mùi vị thực phẩm.
D. Gây hao tốn nhiên liệu và không an toàn cho các nồi hơi, làm tắc các đường ống dẫn nước.
Câu 10: Cho 0,02 mol Na2CO3 tác dụng với lượng dư dung dịch HCl thì thể tích khí CO2 thoát ra (đktc) là
A. 0,672 lít.
B. 0,224 lít.
C. 0,336 lít.
D. 0,448 lít.
Câu 1 (2 điểm): Viết các PTHH xảy ra trong các trường hợp sau:
a/ K tác dụng với Cl2.
b/ Nhiệt phân NaHCO3.
c/ Mg tác dụng với HNO3 loãng (sp khử là N2O).
d/ CO2 tác dụng với Ca(OH)2 dư.
Câu 2 (2 điểm): Cho 11,6 (g) hỗn hợp M gồm 2 kim loại A, B thuộc 2 chu kì liên tiếp trong nhóm IIA của BTH vào dung dịch HCl dư thu được dung dịch X và 7,84 lít khí (ở đkc). Xác định hai kim loại A, B.
Câu 3 (2 điểm): Hấp thụ hoàn toàn 4,48 lít khí CO2 (ở đktc) vào 500 ml dung dịch hỗn hợp gồm NaOH 0,1M và Ba(OH)2 0,2M, sinh ra m gam kết tủa. Tính giá trị của m.
Câu 4 (1 điểm): Đốt cháy hoàn toàn 7,2 gam kim loại M (có hoá trị II không đổi trong hợp chất) trong hỗn hợp khí Cl2 và O2. Sau phản ứng thu được 23,0 gam chất rắn và thể tích hỗn hợp khí đã phản ứng là 5,6 lít (ở đktc). Xác định kim loại M.
| Câu | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Đ/a | B | D | C | C | A | D | C | B | A | D |
Câu 1: FeCl3 + 3NaOH → Fe(OH)3 ↓ + 3NaCl. Chọn đáp án B.
Câu 2: Phương pháp thích hợp điều chế kim loại Ca từ CaCl2 là điện phân CaCl2 nóng chảy. Chọn đáp án D.
Câu 3: So sánh nhóm I: Li, Na, K.Ta có MK lớn nhất → Vkhí thu được là nhỏ nhất.
Giả sử m = 1 gam.
Chọn đáp án C.
Câu 4: Để bảo quản natri, người ta phải ngâm natri trong dầu hỏa. Chọn đáp án C.
Câu 5: Phát biểu sai: Các kim loại kiềm có nhiệt độ nóng chảy tăng dần từ Li đến Cs. Chọn đáp án A.
Câu 6: CO2 + Ca(OH)2 → CaCO3 ↓ trắng + H2O
CaCO3 ↓ + CO2 dư + H2O → Ca(HCO3)2. Chọn đáp án D.
Câu 7: Bảo toàn e: nKL = nkhí = 0,03 mol → MKL = 1,2 : 0,03 = 40. Vậy KL là Ca. Chọn đáp án C.
Câu 8:
V = 0,0125.22,4 = 0,28 lít. Chọn đáp án B.
Câu 9: Nước cứng không gây ngộ độc nước uống. Chọn đáp án A.
Câu 10: Bảo toàn C: nCO2 = nNa2CO3 = 0,02 → V = 0,02.22,4 = 0,448 lít.
Câu 1 (2điểm): HS viết đúng mối PTHH 0,5 điểm, thiếu cân bằng trừ ½ số điểm mỗi PTHH.
Câu 2 (2điểm): Tính được nkhí = 0,35 mol.
Đặt 2 kim loại tương ứng với 1 kim loại là R.
Giả sử MA < MB → MA < MR < MB
MR = 11,6 : 0,35 = 33,14.
Vậy 2 kim loại là Mg (M = 24) và Ca (M = 40).
Câu 3 (2điểm): Tính được: nkhí = 0,2 mol, nOH- = 0,25 mol Đặt 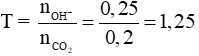
Giải hệ được x = 0,15 và y = 0,05.
Theo (3) → Ba2+ dư, m↓ = 0,05.197 = 9,85 gam.
Câu 4 (1điểm): Tính được nkhí = 0,25 mol
Bảo toàn khối lượng: mkhí = 23 – 7,2 = 15,8 gam
Gọi số mol Cl2, O2 lần lượt là x và y (mol)
nkhí = 0,25 mol → x + y = 0,25
mkhí = 15,8 gam → 71x + 32y = 15,8
Giải hệ được x = 0,2 và y = 0,05.
Bảo toàn e: 2.nM = 2.nCl2 + 4.nO2 → nM = 0,3 mol
MM = 7,2 : 0,3 = 24. Vậy M là Mg.
Chú ý: HS làm theo cách khác đúng vẫn cho điểm tối đa.
…………………………….Hết……………………………
Phòng Giáo dục và Đào tạo .....
Đề thi Giữa học kì 2
Môn: Hóa Học 12
Thời gian làm bài: 45 phút
(Đề 3)
Cho nguyên tử khối của các nguyên tố: C = 12, H = 1, O = 16, Li = 7, Na = 23, K = 39, Rb = 85, Cs = 133, Be = 9, Mg = 24, Ca = 40, Sr = 88, Ba = 137.
Câu 1: Trong các muối sau, muối nào dễ bị nhiệt phân?
A. NaCl.
B. Na2SO4.
C. Na2CO3.
D. NaHCO3.
Câu 2: Nhận định nào sau đây là sai?
A. Kim loại kiềm thuộc nhóm IA của bảng tuần hoàn.
B. Kim loại kiềm có màu trắng bạc và có ánh kim.
C. Từ Li đến Cs khả năng phản ứng với nước càng giảm.
D. Muốn điều chế kim loại kiềm từ các hợp chất, cần phải khử các ion của chúng.
Câu 3: Kim loại có tính khử mạnh nhất là
A. Na.
B. Li.
C. K.
D. Cs.
Câu 4: Thành phần chính của quặng đô – lô – mít là
A. CaCO3.MgCO3.
B. CaCO3.BaCO3.
C. CaCO3.CaSiO3.
D. BaCO3.MgCO3.
Câu 5: Cặp chất không xảy ra phản ứng là
A. dung dịch NaNO3 và dung dịch MgCl2.
B. dung dịch AgNO3 và dung dịch KCl.
C. Na2O và H2O.
D. dung dịch NaOH và Al2O3.
Câu 6: Điện phân nóng chảy muối clorua của một kim loại kiềm thu được 0,896 lít khí (đktc) ở anot và 3,12g kim loại ở catot. Công thức của muối là
A. KCl.
B. LiCl.
C. NaCl.
D. CsCl.
Câu 7: Để khử hoàn toàn 2,32 gam một oxit kim loại, cần dùng 0,896 lít khí H2 ở đktc. Kim loại đó là
A. Mg.
B. Cu.
C. Fe.
D. Cr.
Câu 8: Công dụng nào sau đây không phải của CaCO3
A. Làm vật liệu xây dựng.
B. Sản xuất xi măng.
C. Dùng làm thuốc chữa đau dạ dày.
D. Làm vôi quét tường.
Câu 9: Cho 10 gam một kim loại kiềm thổ tác dụng hết với nước thoát ra 5,6 lít khí (đktc). Kim loại kiềm thổ đó là
A. Ba.
B. Mg.
C. Ca.
D. Sr.
Câu 10: Nước cứng có tính vĩnh cửu có chứa các ion
A. Ca2+, Mg2+, HCO3-.
B. Ca2+, Mg2+, Cl-, NO3-.
C. Ca2+, Mg2+, Cl-, SO42-.
D. Ca2+, Mg2+, NO3-, SO42-.
Câu 1 (2 điểm): Viết các PTHH xảy ra trong sơ đồ sau:
CaCO3 → CaO → Ca(OH)2 → CaOCl2 → CaCl2.
Câu 2 (2 điểm): Hoà tan hoàn toàn 18,4 gam hỗn hợp hai muối cacbonat của hai kim loại X, Y thuộc hai chu kì liên tiếp trong nhóm II A bằng dung dịch HCl thu được 4,48 lít CO2 (đktc). Xác định tên hai kim loại X và Y.
Câu 3 (2 điểm): Sục 0,448 lít khí CO2 (đktc) vào 100ml dung dịch hỗn hợp Ba(OH)2 0,12M và KOH 0,06M. Sau khi các phản ứng xảy ra hoàn toàn thu được m gam kết tủa. Tính giá trị của m.
Câu 4 (1 điểm): Hoà tan 13,68 gam muối MSO4 vào nước được dung dịch X. Điện phân X (với điện cực trơ, cường độ dòng điện không đổi) trong thời gian t giây, được y gam kim loại M duy nhất ở catot và 0,035 mol khí ở anot. Còn nếu thời gian điện phân là 2t giây thì tổng số mol khí thu được ở cả hai điện cực là 0,1245 mol. Tính giá trị của y.

| Câu | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Đ/a | D | C | D | A | A | A | C | C | C | C |
Câu 1: 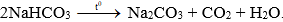
Câu 2: Nhận định sai: “Từ Li đến Cs khả năng phản ứng với nước càng giảm”. Chọn đáp án C.
Câu 3: Kim loại có tính khử mạnh nhất là Cs. Chọn đáp án D.
Câu 4: Thành phần chính của quặng đô – lô – mít là CaCO3.MgCO3. Chọn đáp án A.
Câu 5: Cặp chất không xảy ra phản ứng là dung dịch NaNO3 và dung dịch MgCl2. Chọn đáp án A.
Câu 6:
MM = 3,12 : 0,08 = 39. Vậy muối là KCl. Chọn đáp án A.
Câu 7: Loại đáp án A vì Mg không bị khử bởi H2.
Đặt oxit: AxOy.
Có nO = nH2 = 0,04 mol → mA (oxit) = 1,68 gam.
TH1: A là Cu → nCu (oxit) = 0,02625 → x : y = 0,02625 : 0,04 = 21 : 32 (loại)
TH2: A là Fe → nFe (oxit) = 0,03 → x : y = 3 : 4 → Fe3O4. Chọn đáp án C.
Không cần xét tiếp TH A là Cr.
Câu 8: Công dụng không phải của CaCO3 là dùng làm thuốc chữa đau dạ dày. Chọn đáp án C.
Câu 9: Bảo toàn e có nKL = nkhí = 0,25 mol → MKL = 10 : 0,25 = 40. Vậy KL là Ca. Chọn đáp án C.
Câu 10: Nước cứng có tính vĩnh cửu có chứa các ion Ca2+, Mg2+, Cl-2+, SO42-. Chọn đáp án C.
Câu 1 (2 điểm): HS viết đúng mỗi PTHH 0,5 điểm, sai điều kiện hoặc thiếu cân bằng trừ ½ số điểm mỗi PTHH.
Câu 2 (2 điểm): Tính được số mol khí = 0,2 mol.
Đặt 2 muối tương ứng với một muối là RCO3.
Giả sử Mx < My → Mx < MR < My
MRCO3 = 18,4 : 0,2 = 92 → MR = 32.
Vậy 2 kim loại là Mg và Ca.
Câu 3 (2 điểm): Tính được số mol CO2 = 0,02 và số mol OH- = 0,03 mol.
Giải hệ được: x = y = 0,01
Theo PT (3) → Ba2+ dư, m↓ = 0,01.197 = 1,97 gam.
Câu 4 (1 điểm):
MMSO4 = 13,68 : 0,0855 = 160 → M là Cu.
Tại t (s): nCu = 0,07 mol → mCu = 4,48 gam.
Chú ý: HS làm theo cách khác đúng vẫn cho điểm tối đa.
…………………………….Hết……………………………
Phòng Giáo dục và Đào tạo .....
Đề thi Giữa học kì 2
Môn: Hóa Học 12
Thời gian làm bài: 45 phút
(Đề 4)
Cho nguyên tử khối của các nguyên tố: C = 12, H = 1, O = 16, N = 14, Mg = 24,Cu = 64, Li = 7, Na = 23, K = 39, Be = 9, Ca = 40, Sr = 88, Ba = 137.
Câu 1: Dãy kim loại tác dụng được với H2O ở nhiệt độ thường là
A. Na, K, Be, Mg.
B. Al, Ca, Ba, Na.
C. Na, K, Ba, Al.
D. Na, K, Ba, Ca.
Câu 2: Kim loại nào sau đây được điều chế theo phương pháp nhiệt luyện?
A. Al.
B. Zn.
C. Mg.
D. Ca.
Câu 3: Cho phản ứng:
Sau khi cân bằng, hệ số của phân tử HNO3 là
A. 5x – 2y.
B. 12x – 4y.
C. 10x – 4y.
D. 2x – 4y.
Câu 4: Bảo quản kim loại kiềm bằng cách ngâm trong dầu hỏa vì lý do chính nào sau?
A. Kim loại kiềm không tác dụng với dầu hỏa.
B. Kim loại kiềm chìm trong dầu hỏa.
C. Kim loại kiềm để trong không khí nhanh bị phân hủy.
D. Để kim loại kiềm không tác dụng với các chất trong không khí như hơi nước, O2...
Câu 5: Biết cấu hình electron của M+ là [Ne]. Kết luận nào sau đây đúng?
A. M có cấu hình là 1s22s22p5.
B. M thuộc chu kỳ 2, nhóm VIIIA.
C. M thuộc chu kỳ 3, nhóm IA.
D. Liên kết trong phân tử MCl là liên kết cộng hóa trị.
Câu 6: Chất có thể dùng làm mềm nước cứng tạm thời là
A. NaCl.
B. NaHSO4.
C. Ca(OH)2.
D. HCl.
Câu 7: Cho 2,16 gam Mg tác dụng với dung dịch HNO3 (dư). Sau khi phản ứng xảy ra hoàn toàn thu được 0,896 lít khí NO (ở đktc) và dung dịch X. Khối lượng muối khan thu được khi làm bay hơi dung dịch X là
A. 13,32 gam.
B. 6,52 gam.
C. 8,88 gam.
D. 13,92 gam.
Câu 8: Chất nào sau đây là thạch cao khan?
A. CaSO4.
B. CaO.
C. CaCO3.
D. Ca(OH)2.
Câu 9: Điện phân dung dịch CuSO4 với anot bằng Cu, dòng điện có I = 1,34A trong 15 phút. Sau điện phân khối lượng điện cực catot tăng
A. 0,2 gam.
B. 0,4 gam.
C. 0,6 gam.
D. 0,8 gam.
Câu 10: Cho 0,78 gam một kim loại nhóm IA tác dụng với HCl thu được 0,224 lít khí thoát ra (đktc). Kim loại đó là
A. Li.
B. Na.
C. K.
D. Rb.
Câu 1 (2 điểm): Viết các PTHH xảy ra trong sơ đồ sau:
MgCl2 → Mg → MgO → Mg(NO3)2 → MgO.
Câu 2 (2 điểm): Cho 1,56 gam một kim loại kiềm M vào V ml HCl 2M (vừa đủ) thu được dung dịch A và 0,448 lít khí (đktc).
a/ Xác định tên kim loại M.
b/ Cho 2,34 gam M vào V ml HCl 2M (ở trên) thu được dung dịch B. Cô cạn B thu được a gam chất rắn khan. Xác định a.
Câu 3 (2 điểm): Sục từ từ 8,96 lít CO2 (ở đktc) vào 250 ml Ba(OH)2 1M. Kết thúc thí nghiệm thu được b gam chất rắn A và dung dịch B chứa c gam chất tan. Xác định b, c.
Câu 4 (1 điểm): Nung hỗn hợp gồm 0,12 mol Al và 0,04 mol Fe3O4 một thời gian, thu được hỗn hợp rắn X. Hoà tan hoàn toàn X trong dung dịch HCl dư, thu được 0,15 mol khí H2 và m gam muối. Tính giá trị của m.
| Câu | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Đ/a | D | B | B | D | C | C | D | A | B | C |
Câu 1: Dãy kim loại tác dụng được với H2O ở nhiệt độ thường là Na, K, Ba, Ca. Chọn đáp án D.
Câu 2: Zn được điều chế theo phương pháp nhiệt luyện. Chọn đáp án B.
Câu 3: Chọn đáp án B.
(5x – 2y)Mg + (12x – 4y)HNO3 (loãng) (t˚)-> (5x – 2y)Mg(NO3)2 + 2NxOy + (6x – 2y) H2O
Câu 4: Bảo quản kim loại kiềm bằng cách ngâm trong dầu hỏa để kim loại kiềm không tác dụng với các chất trong không khí như hơi nước, O2... Chọn đáp án D.
Câu 5: CHe của M: 1s22s22p63s1. Vậy M thuộc chu kì 3, nhóm IA. Chọn đáp án C.
Câu 6: Chất có thể dùng làm mềm nước cứng tạm thời là Ca(OH)2. Chọn đáp án C.
Câu 7: Bảo toàn e: nMg.2 = 0,18 > nNO.3 = 0,12. Vậy sản phẩm khử còn NH4NO3: 0,0075 mol.
mmuối = mMg(NO3)2 + mNH4NO3 = 0,09.148 + 0,0075.80 = 13,92g. Chọn đáp án D.
Câu 8: Thạch cao khan: CaSO4. Chọn đáp án A.
Câu 9: 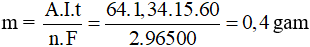
Câu 10: Bảo toàn e: nKL = 2.nKhí = 0,02 mol → MKL = 0,78 : 0,02 = 39. Vậy KL là K.
Chọn đáp án C.
Câu 1 (2điểm): HS viết đúng mỗi PTHH 0,5 điểm, thiếu điều kiện hoặc không cân bằng trừ ½ số điểm mỗi PTHH.
Câu 2 (2điểm):
b/ Tính được số mol K (0,06 mol); HCl (0,04 mol)
a = mKCL + mKOH = 0,04.74,5 + 0,02.56 = 4,1 gam.
Câu 3 (2điểm): Tính được số mol CO2 = 0,4 mol, số mol OH- = 0,5 mol.
Đặt
Sau phản ứng thu được 2 muối BaCO3 (x mol), Ba(HCO3)2 (y mol)
Giải hệ được: x = 0,1 và y = 0,15
b = 0,1.197 = 19,7 gam
c = 0,15.259 = 38,85 gam.
Câu 4 (1điểm): Ta có: mmuối = mKL + mgốc axit
Trong đó khối lượng KL có trong hỗn hợp ban đầu bằng khối lượng kim loại có trong muối sau phản ứng.
→ mKL = 0,12.27 + 0,04.3.56 = 9,96 gam.
Khối lượng gốc axit Cl- được tính từ nHCl phản ứng.
Có nHCl = 2.nH2 + 2.nO(oxit ban đầu) = 2.0,15 + 2.4.0,04 = 0,62 mol.
mgốc axit = 0,62.35,5 = 22,01 gam.
mmuối = 9,96 + 22,01 = 31,97 gam.
Chú ý: HS làm theo cách khác đúng vẫn cho điểm tối đa.
…………………………….Hết……………………………
Phòng Giáo dục và Đào tạo .....
Đề thi Giữa học kì 2
Môn: Hóa Học 12
Thời gian làm bài: 45 phút
(Đề 5)
Cho nguyên tử khối của các nguyên tố: C = 12, H = 1, O = 16, Li = 7, Na = 23, K = 39, Rb = 85, Cs = 133, Be = 9, Mg = 24, Ca = 40, Sr = 88, Ba = 137.
Câu 1: Khử hoàn toàn hỗn hợp gồm: CuO, FeO, MgO, PbO bằng khí CO. Chất rắn thu được sau phản ứng là
A. Cu, FeO, MgO, PbO.
B. Cu, Fe, MgO, PbO.
C. Cu, Fe, MgO, Pb.
D. Cu, Fe, Mg, PbO.
Câu 2: Chất nào sau đây được ứng dụng làm bột nở trong công nghiệp thực phẩm?
A. KNO3.
B. NaHCO3.
C. NaOH.
D. CaSO4.
Câu 3: Trong công nghiệp, Na được điều chế bằng cách nào dưới đây?
A. Điện phân nóng chảy Na2CO3.
B. Điện phân dung dịch NaCl có màng ngăn.
C. Khử NaCl bằng K.
D. Điện phân nóng chảy NaCl.
Câu 4: Chất nào sau đây có thể làm mềm nước cứng có tính vĩnh cửu?
A. NaCl.
B. H2SO4.
C. Na2CO3.
D. HCl.
Câu 5: Cho 6 gam hỗn hợp gồm Na và kim loại kiềm M tác dụng hết với nước được dung dịch X. Để trung hòa hết X cần 1,8 lít HCl 0,25M. Kim loại M là
A. Li.
B. K.
C. Rb.
D. Cs.
Câu 6: Bằng phương pháp hóa học, để phân biệt các dung dịch riêng biệt: K2SO4, MgCl2, AlCl3, có thể chỉ dùng một dung dịch là
A. AgNO3.
B. BaCl2.
C. KOH.
D. HNO3.
Câu 7: Cho H2 dư đi từ từ qua hỗn hợp X gồm: 16 gam Fe2O3 và 8 gam MgO nung nóng đến phản ứng hoàn toàn thu được a gam chất rắn Y. Giá trị của a là
A. 16.
B. 11,2.
C. 19,2.
D. 20,8.
Câu 8: Cho 0,2 gam một kim loại thuộc nhóm IIA tác dụng hết với dung dịch HCl thấy tạo ra 0,555 gam muối. Kim loại đó là
A. Be.
B. Mg.
C. Ba.
D. Ca.
Câu 9: Phát biểu nào sau đây là sai ?
A. Điều kiện để một kim loai A đẩy kim loại B ra khỏi muối là A phải mạnh hơn B.
B. Nguyên tử kim loại chỉ có tính khử, không có tính oxi hóa.
C. Kim loại có độ cứng lớn nhất là Cr.
D. Trạng thái cơ bản, kim loại kiềm thổ có số electron hóa trị là 2.
Câu 10: Điện phân nóng chảy muối clorua của kim loại M. Ở catot thu được 3 gam kim loại và ở anot có 1,68 lít khí ở đktc thoát ra. Muối clorua đó là
A. NaCl.
B. KCl.
C. BaCl2.
D. CaCl2.
Câu 1 (2 điểm): Không dùng chỉ thị, hãy phân biệt các dung dịch sau chứa trong lọ mất nhãn: KCl, BaCl2, Na2CO3.
Câu 2 (2 điểm): Cho 6,08 gam hỗn hợp X gồm 2 hiđroxit của 2 kim loại kiềm tác dụng hết với dung dịch HCl dư thấy tạo ra 8,30 gam hỗn hợp muối clorua. Biết 2 kim loại kiềm thuộc 2 chu kì liên tiếp trong BTH, tính % số mol mỗi hiđroxit trong hỗn hợp ban đầu.
Câu 3 (2 điểm): Dẫn V lít CO2 (đktc) vào dung dịch Ca(OH)3 thu được 25 gam kết tủa và dung dịch X, đun nóng dung dịch lại thu thêm được 5 gam kết tủa nữa. Tính giá trị của V.
Câu 4 (1 điểm): Sau phản ứng nhiệt nhôm của hỗn hợp X gồm bột Al với FexOy thu được 9,39 gam chất rắn Y. Cho toàn bộ Y tác dụng với dung dịch NaOH dư thấy có 336 ml khí (đktc) bay ra và phần không tan Z. Để hòa tan 1/3 lượng chất Z cần 12,4 ml dung dịch HNO3 65,3% (d = 1,4 g/ml) và thấy có khí màu nâu đỏ bay ra. Xác định công thức của FexOy.
| Câu | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Đ/a | C | B | D | C | A | C | C | D | A | D |
Câu 1: Chất rắn thu được sau phản ứng là Cu, Fe, MgO, Pb. Chọn đáp án C.
Câu 2: NaHCO3 được ứng dụng làm bột nở trong công nghiệp thực phẩm. Chọn đáp án B.
Câu 3: Trong công nghiệp, Na được điều chế bằng cách điện phân nóng chảy NaCl. Chọn đáp án D.
Câu 4: Na2CO3 có thể làm mềm nước cứng có tính vĩnh cửu. Chọn đáp án C.
Câu 5: Đặt 2 kim loại tương ứng với 1 kim loại là X.
MX = 6 : 0,45 = 13,33. Vậy M là Li. Chọn đáp án A.
Câu 6: Dùng dung dịch KOH.
+ Xuất hiện kết tủa trắng → MgCl2.
+ Xuất hiện kết tủa keo trắng, tan trong KOH dư → AlCl3.
+ Không hiện tượng: K2SO4. Chọn đáp án C.
Câu 7: 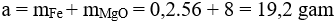
Câu 8:
Ta có 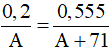
Câu 9: Phát biểu sai: “Điều kiện để một kim loai A đẩy kim loại B ra khỏi muối là A phải mạnh hơn B”. Chọn đáp án A.
Câu 10:
Vậy n = 2, M = 40 thỏa mãn. Muối là CaCl2. Chọn đáp án D.
Câu 1 (2điểm):
Đánh số thứ tự từng lọ, trích mỗi lọ một ít sang ống nghiệm đánh số tương ứng.
Nhỏ HCl vào từng mẫu thử, mẫu thử nào có khí thoát ra là Na2CO3, không hiện tượng là KCl và BaCl2 (nhóm I)
2HCl + Na2CO3 → 2NaCl + CO2 ↑ + H2O
Dùng Na2CO3 vừa nhận ra cho vào hai mẫu thử nhóm I, mẫu thử nào có kết tủa trắng là BaCl2, không hiện tượng là KCl.
Na2CO3 + BaCl2 → BaCO3 ↓ + 2NaCl.
Câu 2 (2điểm):
Giả sử 2 kim loại là A và B (MA < MB), đặt 2 kim loại tương ứng với 1 KL là R → MA < MR < MB.
PTHH:
Sử dụng PP tăng giảm khối lượng: a = (8,3 – 6,08) : 18,5 = 0,12 mol
MROH = 6,08 : 0,12 = 50,67 → R = 33,67.
Vậy 2 hiđroxit là NaOH (x mol) và KOH (y mol)
Giải hệ được: x = 0,04 và y = 0,08
→ %nNaOH = 33,33%; %nKOH = 66,67%.
Câu 3 (2điểm): Theo bài ra ta có các PTHH:
→ nCO2 = 0,35 mol
→ V = 7,84 lít.
Câu 4 (1điểm):
Chú ý: HS làm theo cách khác đúng vẫn cho điểm tối đa.
…………………………….Hết……………………………