Viết cấu hình electron theo ô orbital của nguyên tử các nguyên tố có Z = 9, Z = 14 và Z = 21. Chúng là nguyên tố kim loại, phi kim hay khí hiếm?
 Giải bởi Vietjack
Giải bởi Vietjack
+) Z = 9 (1s22s22p5): nguyên tử có 7 electron hóa trị, dễ thu electron, là phi kim.
Cấu hình electron theo ô orbital:
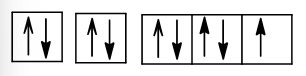
+) Z = 14 (1s22s22p63s23p2): nguyên tử có 4 electron hóa trị nên có thể thu electron hoặc nhường electron, là phi kim.
Cấu hình electron theo ô orbital:
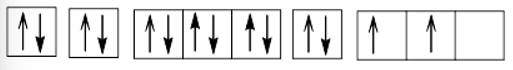
+) Z = 21 (1s22s22p63s23p63d14s2): nguyên tử có 3 electron hóa trị, dễ nhường electron, là kim loại.

Hợp chất A có công thức M4X3. Tổng số hạt proton, electron và neutron trong phân tử A là 214. Tổng số hạt proton, neutron, electron của [M]4 nhiều hơn so với [X]3 trong A là 106.
a) Xác định công thức hóa học của A.
b) Viết cấu hình electron của các nguyên tử tạo nên A.
Nguyên tố X có Z = 17. Electron lớp ngoài cùng của nguyên tử nguyên tố X thuộc lớp
Ở trạng thái cơ bản, trong nguyên tử, electron chiếm các mức năng lượng
Nguyên tố X có Z = 12 và nguyên tố Y có Z = 17.
Viết cấu hình electron nguyên tử của nguyên tố X và Y. Khi nguyên tử của nguyên tố X nhường đi hai electron và nguyên tử của nguyên tố Y nhận thêm một electron thì lớp electron ngoài cùng của chúng có đặc điểm gì?
Sự phân bố electron trên các phân lớp thuộc các lớp electron dựa vào nguyên lí hay quy tắc nào sau đây?