Trong tự nhiên nguyên tố copper (kí hiệu: Cu) có 2 đồng vị là và , trong đó đồng vị chiếm 27% về số nguyên tử. Tính phần trăm khối lượng của trong phân tử Cu2O (biết rằng nguyên tử khối trung bình của O bằng 16).
 Giải bởi Vietjack
Giải bởi Vietjack
Nguyên tử khối trung bình của copper là:
Phân tử khối của Cu2O là: 2.63,54 + 16 = 143,08.
Phần trăm khối lượng của trong phân tử Cu2O là:
Lý thuyết Nguyên tố hóa học
I. Nguyên tố hóa học
Nguyên tố hóa học là tập hợp các nguyên tử có cùng số đơn vị điện tích hạt nhân. Trong nguyên tử, số đơn vị điện tích hạt nhân bằng số electron ở vỏ nguyên tử. Các electron trong nguyên tử quyết định tính chất hóa học của nguyên tử, nên các nguyên tử của cùng một nguyên tố hóa học có tính chất hóa học giống nhau.
Ví dụ 1: Tất cả nguyên tử có cùng số đơn vị điện tích hạt nhân là 6 đều thuộc nguyên tố carbon dù chúng có thể có số neutron khác nhau.
Ví dụ 2: Cho các nguyên tử sau: B (Z = 8, A = 16), D (Z = 7, A = 14), E (Z = 9, A = 19), F (Z = 8, A = 18).
Trong các nguyên tử trên, nguyên tử B và F thuộc cùng một nguyên tố hóa học vì có cùng số đơn vị điện tích hạt nhân (Z = 8).
II. Kí hiệu nguyên tử
Số đơn vị điện tích hạt nhân nguyên tử của một nguyên tố hóa học (còn được gọi là số hiệu nguyên tử (Z) của nguyên tố đó) và số khối (A) là những đặc trưng cơ bản của một nguyên tử.
Khi viết kí hiệu nguyên tử, đặt hai chỉ số đặc trưng ở bên trái kí hiệu nguyên tố, trong đó số hiệu nguyên tử Z ở phía dưới và số khối A ở phía trên.
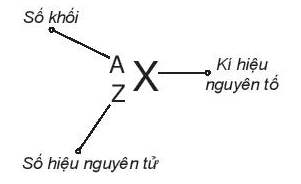
Ví dụ 1: Kí hiệu nguyên tử helium là . Cho biết:
+ Nguyên tử helium có kí hiệu là He.
+ Số hiệu nguyên tử helium là Z = 2 = số proton = số electron.
+ Số khối của nguyên tử helium là A = 4.
A = Z + N Số neutron = N = A – Z = 4 – 2 = 2.
Ví dụ 2: Nguyên tử nitrogen có 7 proton và 7 neutron.
Ta có:
+ Số hiệu nguyên tử Z = số proton = 7.
+ Số khối của nguyên tử nitrogen là A = Z + N = 7 + 7 = 14.
Kí hiệu nguyên tử nitrogen là .
III. Đồng vị
Đồng vị là những nguyên tử có cùng số đơn vị điện tích hạt nhân (cùng số proton) nhưng có số neutron khác nhau.
Ví dụ 1: Mô hình cấu tạo nguyên tử các đồng vị của nguyên tố hydrogen.
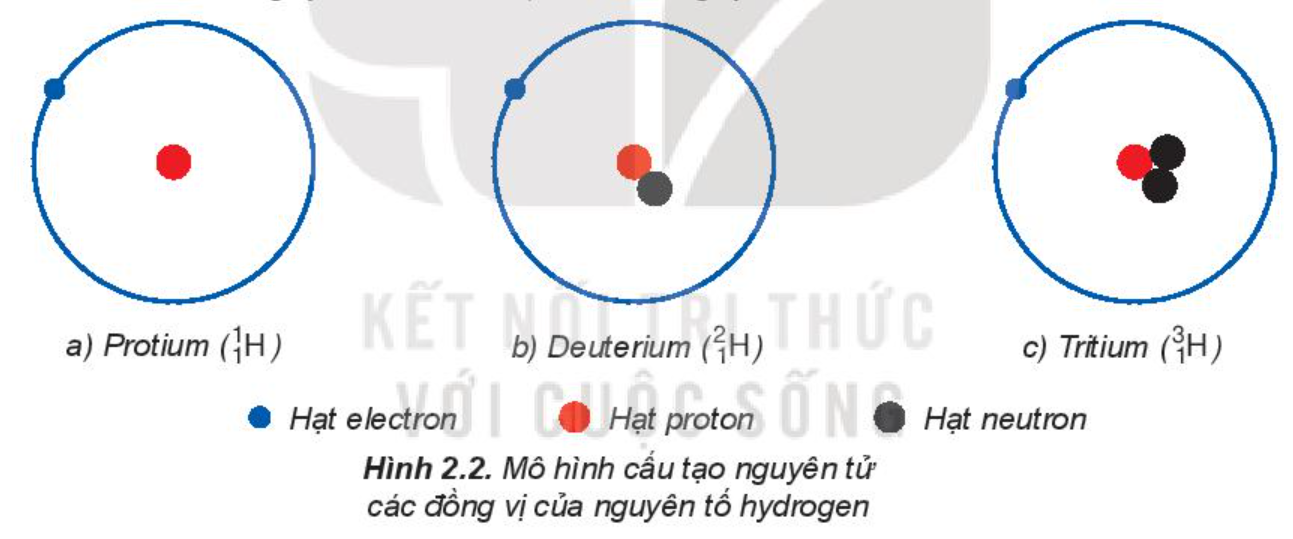 Các đồng vị khác nhau về số neutron nên khác nhau về khối lượng của hạt nhân nguyên tử, đồng thời khác nhau về một số tính chất vật lí.
Các đồng vị khác nhau về số neutron nên khác nhau về khối lượng của hạt nhân nguyên tử, đồng thời khác nhau về một số tính chất vật lí.
Ví dụ 2: Ở dạng đơn chất, đồng vị có tỉ khối lớn hơn, nhiệt độ nóng chảy và nhiệt độ sôi cao hơn đồng vị .
IV. Nguyên tử khối
1. Nguyên tử khối
Nguyên tử khối là khối lượng của nguyên tử, cho biết khối lượng của nguyên tử đó nặng gấp bao nhiêu lần đơn vị khối lượng nguyên tử. Do khối lượng proton và neutron đều xấp xỉ 1,0 amu, còn khối lượng electron nhỏ hơn rất nhiều (0,00055 amu), nên có thể coi khối lượng nguyên tử xấp xỉ số khối.
Ví dụ: Nguyên tử của nguyên tố potassium có 19 proton và 20 neutron.
Nguyên tử khối của potassium là A = 19 + 20 = 39.
2. Nguyên tử khối trung bình
Nguyên tử khối của một nguyên tố là nguyên tử khối trung bình (kí hiệu ) của hỗn hợp các đồng vị của nguyên tố đó.
Biểu thức tổng quát tính nguyên tử khối trung bình ():
Trong đó, là nguyên tử khối trung bình; X và Y, … lần lượt là nguyên tử khối của các đồng vị X và Y, …; a và b, … lần lượt là % số nguyên tử của các đồng vị X và Y, …
Ví dụ 1: Trong tự nhiên, nguyên tố chlorine có hai đồng vị bền là (chiếm 75,77%) và (chiếm 24,23% số nguyên tử).
Nguyên tử khối trung bình của chlorine: .
Ví dụ 2: Nguyên tử khối trung bình của copper bằng 63,546. Copper tồn tại trong tự nhiên dưới hai dạng đồng vị và . Tính phần trăm số nguyên tử của đồng vị tồn tại trong tự nhiên.
Hướng dẫn:
Gọi phần trăm số nguyên tử của đồng vị và lần lượt là x (%) và y (%).
Ta có: x + y = 100 (*).
Nguyên tử khối trung bình của copper: (**).
Từ (*) và (**), suy ra: x = 72,7 và y = 27,3.
Sơ đồ tư duy Lý thuyết Nguyên tố hóa học
Xem thêm một số kiến thức liên quan:
Lý thuyết Nguyên tố hóa học (Chân trời sáng tạo) hay, chi tiết | Hóa học 10
20 câu Trắc nghiệm Nguyên tố hóa học (Chân trời sáng tạo) có đáp án – Hóa học lớp 10
Nguyên tử của nguyên tố X có electron ở mức năng lượng cao nhất là 3p. Nguyên tử của nguyên tố Y cũng có electron ở mức năng lượng 3p và có một electron ở lớp ngoài cùng. Nguyên tử X và Y có số electron hơn kém nhau là 2. Nguyên tố X, Y lần lượt là
Nguyên tử nguyên tố X có tổng số hạt electron trong các phân lớp s là 5. Số electron của X ít hơn số electron của Y là 4 hạt.
Xác định vị trí X, Y trong bảng tuần hoàn có giải thích ngắn gọn.
Số hiệu nguyên tử của nguyên tố Y là 19. Vị trí của Y trong bảng tuần hoàn là
Nguyên tử sulfur có phân lớp electron ngoài cùng là 3p4. Phát biểu nào sau đây là sai khi nói về nguyên tử sulfur?
Cho 2 kí hiệu nguyên tử sau: .
Biểu diễn cấu hình electron của A, B theo ô orbital, từ đó cho biết số electron độc thân của mỗi nguyên tử.
Số proton và số neutron có trong một nguyên tử aluminium () lần lượt là
Nguyên tử của nguyên tố M có cấu hình electron là 1s22s22p4. Số electron độc thân của M ở trạng thái cơ bản là