 Giải bởi Vietjack
Giải bởi Vietjack
Lời giải:
CHCl3 là một phân tử phân cực, trong khi CCl4 là một phân tử không phân cực. Như vậy, CHCl3 đáng lí phải có nhiệt độ sôi cao hơn CCl4. Tuy nhiên, thực tế CCl4 lại có nhiệt độ sôi cao là 76,8oC, cao hơn so với CHCl3 là 61,2oC. Điều này được giải thích do phân tử CCl4 có kích thước lớn hơn CHCl3 nên có số electron cũng nhiều hơn CHCl3, do đó tương tác van der Waals giữa các phân tử CCl4 mạnh hơn CHCl3, làm cho CCl4 có nhiệt độ sôi cao hơn CHCl3.
Biểu diễn liên kết hydrogen giữa các phân tử sau:
a. methanol (CH3OH) và nước.
b. ethylene glycol (HOCH2CH2OH) và nước
Từ đó nhận xét tính tan của methanol và ethylene glycol trong nước.
Mặc dù chlorine có độ âm điện là 3,16 xấp xỉ với nitrogen là 3,04 nhưng giữa các phân tử HCl không tạo được liên kết hydrogen với nhau, trong khi giữa các phân tử NH3 tạo được liên kết hydrogen với nhau, nguyên nhân là do
Nhiệt độ sôi của các hợp chất với hydrogen của các nguyên tố nhóm VA, VIA và VIIA được biểu diễn qua đồ thị sau:
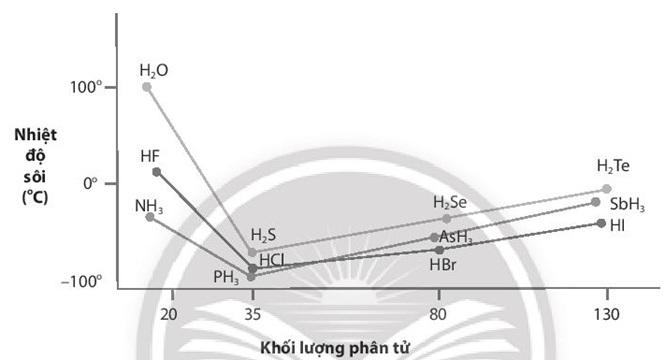
Giải thích nhiệt độ sôi cao bất thường của các hợp chất với hydrogen của các nguyên tố đầu tiên trong mỗi nhóm.