Tailieumoi.vn xin giới thiệu phương trình FeCl2 + 2H2O + 2Na → H2↑ + 2NaCl + Fe(OH)2↓ gồm điều kiện phản ứng, cách thực hiện, hiện tượng phản ứng và một số bài tập liên quan giúp các em củng cố toàn bộ kiến thức và rèn luyện kĩ năng làm bài tập về phương trình phản ứng hóa học của Sắt. Mời các bạn đón xem:
Phương trình FeCl2 + 2H2O + 2Na → H2↑ + 2NaCl + Fe(OH)2↓
1. Phương trình phản ứng hóa học
FeCl2 + 2H2O + 2Na → H2↑ + 2NaCl + Fe(OH)2↓
2. Hiện tượng nhận biết phản ứng
- Xuất hiện kết tủa màu trắng xanh Fe(OH)2 trong dung dịch đồng thời có khí H2 thoát ra
3. Điều kiện phản ứng
- Nhiệt độ phòng.
4. Tính chất hoá học
4.1. Tính chất hoá học của FeCl2
- Mang đầy đủ tính chất hóa học của muối.
- Có tính khử Fe2+ → Fe3+ + 1e
Tính chất hóa học của muối:
- Tác dụng với dung dịch kiềm:
FeCl2 + 2NaOH → Fe(OH)2 + 2NaCl
- Tác dụng với muối
FeCl2 + 2AgNO3 → Fe(NO3)2 + 2AgCl
Tính khử:
- Thể hiện tính khử khi tác dụng với các chất oxi hóa mạnh:
2FeCl2 + Cl2 → 2FeCl3
4.2. Tính chất hoá học của Natri
- Natri có tính khử rất mạnh: Na → Na+ + 1e
a. Tác dụng với phi kim
4Na + O2 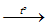
2Na + Cl2 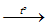
- Khi đốt trong không khí hay trong oxi, Na cháy tạo thành các oxit (oxit thường, peoxit và supeoxit) và cho ngọn lửa có màu vàng đặc trưng.
b. Tác dụng với axit
- Natri dễ dàng khử ion H+ trong dung dịch axit loãng (HCl, H2SO4 loãng...) thành hidro tự do.
2Na + 2HCl → 2NaCl + H2.
2Na + H2SO4 → Na2SO4 + H2.
c. Tác dụng với nước
- Natri đều tác dụng mãnh liệt với nước tạo thành dung dịch kiềm và giải phóng khí hidro.
2Na + 2H2O → 2NaOH + H2.
d. Tác dụng với hidro
- Natri tác dụng với hidro ở áp suất khá lớn và nhiệt độ khoảng 350 – 400oC tạo thành natri hidrua.
2Na (lỏng) + H2 (khí) 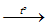
4.3. Tính chất hoá học của nước
– Tác dụng với kim loại: nước có thể tác dụng với một số kim loại ở nhiệt độ thường như Ca, Ba, K,…
K + H2O → KOH + H2
– Tác dụng với một số oxit bazo như CaO, K2O,… tạo ra bazo tương ứng Ca(OH)2, KOH,…
CaO + H2O → Ca(OH)2
– Tác dụng với oxit axit như SO3, P2O5,… tạo thành axit tương ứng H2SO4, H3PO4,…
SO3 + H2O → H2SO4
5. Cách thực hiện phản ứng
- Cho FeCl2 tác dụng với Na trong nước
6. Bài tập liên quan
Ví dụ 1: Ở điều kiện thường Fe phản ứng với dung dịch nào sau đây:
A. FeCl3.
B. ZnCl2.
C. NaCl.
D. MgCl2.
Hướng dẫn giải
Fe + 2FeCl3 → 3FeCl2
Đáp án : A
Ví dụ 2: Một loại quặng sắt (sau khi loại bỏ tạp chất) cho tác dụng với HNO3 không có khí thoát ra. Tên của quặng là
A.Hematit.
B. Manhetit.
C. Pirit.
D. Xiđerit.
Hướng dẫn giải
Quặng sắt tác dụng HNO3 không có khí thoát ra → quặng sắt chứa Fe2O3.
→ Quặng hematit
Đáp án : A
Ví dụ 3: Cho ít bột Fe vào dung dịch AgNO3 dư, sau khi kết thúc thí nghiệm thu được dung dịch X gồm
A. Fe(NO3)2, H2O
B. Fe(NO3)3, AgNO3 dư.
C. Fe(NO3)2, AgNO3 dư
D. Fe(NO3)2, Fe(NO3)3, AgNO3 dư.
Hướng dẫn giải
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag↓
Fe(NO3)2 + AgNO3 dư → Fe(NO3)3 + Ag↓
→ Dung dịch X gồm Fe(NO3)3, AgNO3
Đáp án : B
7. Một số phương trình phản ứng hoá học khác của Sắt (Fe) và hợp chất:
FeCl2 + 2H2O + 2CH3NH2 → Fe(OH)2↓ + 2CH3NH3Cl
Phương trình nhiệt phân 2FeCl3 → Cl2 ↑+ 2FeCl2