Tailieumoi.vn xin giới thiệu phương trình 4Fe(OH)2 + O2 → 2Fe2O3 + 4H2O gồm điều kiện phản ứng, cách thực hiện, hiện tượng phản ứng và một số bài tập liên quan giúp các em củng cố toàn bộ kiến thức và rèn luyện kĩ năng làm bài tập về phương trình phản ứng hóa học của Sắt. Mời các bạn đón xem:
Phương trình 4Fe(OH)2 + O2 → 2Fe2O3 + 4H2O
1. Phương trình phản ứng hóa học:
4Fe(OH)2 + O2 → 2Fe2O3 + 4H2O
2. Hiện tượng nhận biết phản ứng
- Chất rắn màu trắng xanh Fe(OH)2 chuyển dần sang màu đen của Fe2O3
3. Điều kiện phản ứng
- Nhiệt độ cao
4. Tính chất hoá học
4.1. Tính chất hoá học của Fe(OH)2
- Có tính chất của bazo không tan.
- Vừa có tính oxi hóa vừa có tính khử.
Bị nhiệt phân
- Nung Fe(OH)2 trong điều kiện không có không khí
Fe(OH)2 
- Nung Fe(OH)2 trong không khí
4Fe(OH)2 + O2 
Tác dụng với axit
- Với axit không có tính oxi hóa như (HCl, H2SO4)
Fe(OH)2 + 2HCl → FeCl2 + 2H2O
Tính khử:
- Với axit HNO3, H2SO4 đặc
3Fe(OH)2 + 10HNO3 loãng → 3Fe(NO3)3 + NO + 8H2O
2Fe(OH)2 + 4H2SO4 → Fe2(SO4)3 + SO2 + 4H2O
- Tác dụng với các chất oxi hóa khác
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3
4.2. Tính chất hoá học của O2
Khi tham gia phản ứng, nguyên tử O dễ dàng nhận thêm 2e. Nguyên tử oxi có độ âm điện lớn (3,44), chỉ kém flo (3,98).
Do vậy, oxi là nguyên tố phi kim hoạt động hoá học, có tính oxi hoá mạnh. Trong các hợp chất (trừ hợp chất với flo), nguyên tố oxi có số oxi hoá là -2.
Oxi tác dụng với hầu hết các kim loại (trừ Au, Pt, ...) và các phi kim (trừ halogen). Oxi tác dụng với nhiều hợp chất vô cơ và hữu cơ.
Tác dụng với kim loại
Tác dụng với hầu hết kim loại (trừ au và Pt), cần có to tạo oxit:
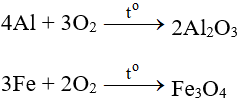
Tác dụng với phi kim
Tác dụng với hầu hết phi kim (trừ halogen), cần có to tạo oxit:
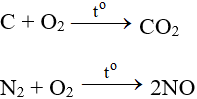
ĐB: Tác dụng với H2 nổ mạnh theo tỉ lệ 2:1 về số mol:
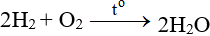
Tác dụng với hợp chất
- Tác dụng với các chất có tính khử:
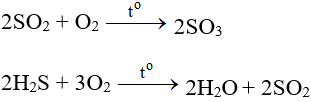
- Tác dụng với các chất hữu cơ:
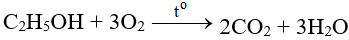
5. Cách thực hiện phản ứng
- Cho Fe(OH)2 phản ứng với oxi
6. Bạn có biết
Cr(OH)2 cũng có phản ứng tương tự với oxi
7. Bài tập liên quan
Ví dụ 1: Trong các hợp chất, sắt có số oxi hóa là :
A. +2
B. +3
C. +2; +3
D.0; +2; +3.
Hướng dẫn giải
Đáp án : C
Ví dụ 2: Cho dây sắt nóng đỏ tác dụng với oxi thu được oxit sắt từ. Công thức của oxit sắt từ:
A. FeO
B. Fe3O4
C. Fe2O3
D. Fe2O3.nH2O
Hướng dẫn giải
Phương trình phản ứng: 3Fe + 2O2 → Fe3O4
Đáp án : B
Ví dụ 3: Sắt tác dụng với H2O ở nhiệt độ cao hom 570°C thì tạo ra H2 và sản phẩm rắn là
A. FeO.
B. Fe3O4.
C. Fe2O3.
D. Fe(OH)2.
Hướng dẫn giải
Fe tác dụng H2O ở t° > 570°C sẽ tạo FeO
t° < 570°C sẽ tạo Fe3O4
Đáp án : A
8. Một số phương trình phản ứng hoá học khác của Sắt (Fe) và hợp chất:
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3
2Fe(OH)2 + NaClO + H2O → NaCl + 2Fe(OH)3
Fe(OH)2 + H2SO4 → 2H2O + FeSO4
2Fe(OH)2 + 4H2SO4 → Fe2(SO4)3 + 6H2O + SO2
Fe(OH)2 + 2HNO3 → Fe(NO3)2 + 2H2O
3Fe(OH)2 + 10HNO3 → 8H2O + NO↓ + 3Fe(NO3)3