Tailieumoi.vn xin giới thiệu bài viết Công thức Lewis của NH3 (Ammonia) theo chương trình mới, và một số bài tập kèm theo giúp bạn nắm vững kiến thức, học tốt môn Hóa hơn.
Công thức Lewis của NH3 theo chương trình mới, đầy đủ nhất
1. Cách viết công thức Lewis
a) Cách 1: Viết công thức Lewis dựa vào công thức electron
Từ công thức electron, thay 1 cặp electron dùng chung bằng 1 gạch nối giữa hai nguyên tử ta được công thức Lewis
Từ công thức electron của NH3 ta thấy mỗi nguyên tử H liên kết với nguyên tử N bằng 1 cặp electron, ta thay mỗi cặp electron này bằng một gạch nối “–”. Ta được công thức Lewis của NH3 là:
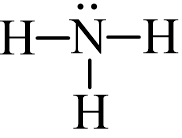
b) Cách 2: Thực hiện lần lượt theo các bước sau
Bước 1: Tính tổng số electron hóa trị trong phân tử
Nitrogen (N) có 5 electron hóa trị, hydrogen có 1 electron hóa trị. Trong phân tử NH3 có 1 nguyên tử N và 3 nguyên tử H.
Vậy tổng số electron hóa trị = 5 + 3.1 = 8 electron
Bước 2: Vẽ khung phân tử tạp bởi liên kết đơn giữa các nguyên tử
Trong phân tử NH3, nguyên tử N cần 3 electron để đạt octet, mỗi nguyên tử H cần 1 electron để đạt octet. Vì vậy, N là nguyên tử trung tâm, còn các nguyên tử H được xếp xung quanh:
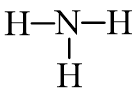
Bước 3: Tính số electron hóa trị chưa tham gia liên kết bằng cách lấy tổng số electron trừ số electron tham gia tạo liên kết.
Số electron hóa trị chưa tham gia liên kết trong sơ đồ là: 8 – 2.3 = 2 electron.
Hoàn thiện octet cho các nguyên tử có độ âm điện lớn hơn trong sơ đồ.
Từ công thức (1), nguyên tử H đã đủ octet, hoàn thiện octet cho N. Xung quanh nguyên tử N mới có 6 electron, ta bổ sung 2 electron vào nguyên tử N. Ta được công thức (2) chính là công thức Lewis của NH3:
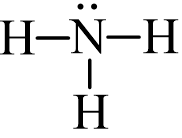 (2)
(2)
- Nhận xét:
+ ∆χ(N – H) = |3,04 – 2,2| = 0,84 ⇒ Liên kết N – H trong phân tử NH3 thuộc loại liên kết cộng hóa trị phân cực. Liên kết N – H phân cực về phía nguyên tử N.
+ Liên kết N – H được hình thành do sự xen phủ orbital s – p
+ Phân tử NH3 có dạng tháp tam giác
2. Cách viết công thức cấu tạo
Từ công thức Lewis, ta loại bỏ đi các electron tự do (electron không tham gia liên kết) thu được công thức cấu tạo.
- Công thức cấu tạo của NH3 là:
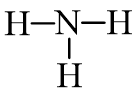
- Nhận xét: Trong phân tử NH3 có 3 liên kết đơn N – H.
3. Công thức electron của NH3
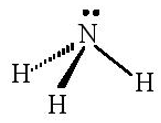
- Sự tạo thành phân tử NH3: Nguyên tử hydrogen (H) có cấu hình electron là 1s1, nguyên tử nitrogen (N) có cấu hình electron là 1s22s22p3. Để đạt được cấu hình electron bền vững của khí hiếm gần nhất, nguyên tử N cần thêm 3 electron, mỗi nguyên tử H cần thêm 1 electron. Khi hình thành phân tử NH3, mỗi nguyên tử H góp chung 1 electron với nguyên tử N tạo thành 1 cặp electron dùng chung, ba nguyên tử H sẽ tạo thành 3 cặp electron với nguyên tử N.
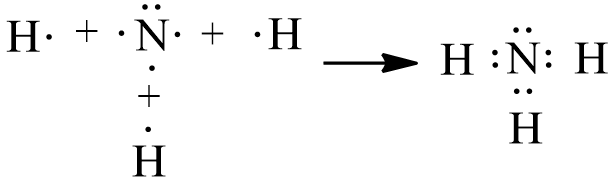
- Công thức electron của NH3 là:
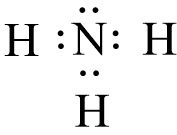
- Nhận xét:
+ Phân tử NH3 có 3 cặp electron dùng chung. Cặp electron chung bị lệch về phía nguyên tử N.
+ Trong phân tử NH3, nguyên tử N còn 1 cặp electron tự do, nguyên tử H không còn electron tự do.
4. Bài tập mở rộng về NH3
Câu 1. Liên kết trong phân tử nào dưới đây không được hình thành do sự xen phủ giữa các orbital cùng loại (ví dụ cùng là orbital s, hoặc cùng là orbital p)?
A. Cl2.
B. H2.
C. NH3.
D. Br2.
Hướng dẫn giải
Đáp án đúng là: C
Hydrogen (H) có cấu hình electron là 1s1
Nitrogen (N) có cấu hình electron là 1s22s22p3
Liên kết trong phân tử NH3 được hình thành do AO s (của H) xen phủ với AO p (của N).
Câu 2. Cho biết nguyên tử nitrogen (N) có 5 electron hóa trị. Số cặp electron dùng chung trong phân tử NH3 là
A. 1
B. 2
C. 3
D. 4
Hướng dẫn giải
Đáp án đúng là: C
Nguyên tử nitrogen (N) có 5 electron hóa trị. Để đạt được cấu hình electron bền vững của khí hiếm gần nhất, nguyên tử N cần thêm 3 electron, mỗi nguyên tử H cần thêm 1 electron. Khi hình thành phân tử NH3, mỗi nguyên tử H góp chung 1 electron với nguyên tử N tạo thành 1 cặp electron dùng chung, ba nguyên tử H sẽ tạo thành 3 cặp electron với nguyên tử N.
Công thức electron của NH3 là:
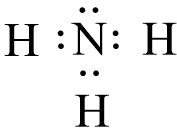
Vậy trong phân tử NH3 có 3 cặp electron dùng chung giữa N và H.
Câu 3. Mô tả sự tạo thành phân tử NH3 sau theo khái niệm lai hóa orbital.
Hướng dẫn giải:
Công thức Lewis của NH3 là:
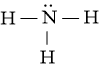
⇒ Công thức VSEPR của NH3 là: AX3E1
Từ công thức VSEPR dự đoán được trạng thái lai hóa của nguyên tử N trong phân tử NH3 là sp3.
Cấu hình electron của N là: 1s22s22p3
1 AO 2s tổ hợp với 3 AO 2p tạo 4 AO lai hóa sp3
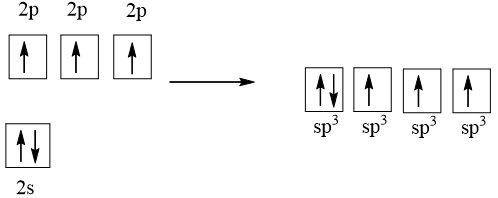
Ba AO lai hóa sp3 (chứa electron độc thân) của nguyên tử N xen phủ với AO 1s của 3 nguyên tử H, tạo va liên kết σ, hướng về ba đỉnh của hình tứ diện. Nguyên tử N còn 1 AO lai hóa sp3 chứa một cặp electron chưa liên kết nằm hướng về đỉnh còn lại của tứ diện. Tuy nhiên cặp electron chưa liên kết này đẩy mạnh hơn nên làm góc liên kết giảm, nên nhỏ hơn 109,5o
Câu 4. Trình bày các bước để viết công thức Lewis của phân tử NH3.
Hướng dẫn giải:
Bước 1. Tổng số electron hóa trị = 1.5 + 3.1 = 8 electron
Bước 2. Trong phân tử NH3, nguyên tử N cần 3 electron để đạt octet, nguyên tử H cần 1 electron hóa trị để đạt octet. Vì vậy, N là nguyên tử trung tâm, còn các nguyên tử H được xếp xung quanh:
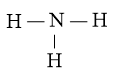
Bước 3. Nguyên tử H đã đạt octet.
Bước 4. Số electron hóa trị còn lại là: 8 – 2.3 = 2
⇒ Chuyển 2 electron còn lại vào nguyên tử N để đạt octet, thu được công thức Lewis của phân tử NH3.
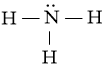
Xem thêm công thức Lewis của một số chất thường gặp hay, chi tiết khác:
Công thức Lewis của CH4 (chương trình mới)
Công thức Lewis của SO2 (chương trình mới)
Công thức Lewis của CO (chương trình mới)
Công thức Lewis của SO3 (chương trình mới)
Công thức Lewis của HNO3 (chương trình mới)