Tailieumoi.vn xin giới thiệu phương trình HCOOC2H5 + 2AgNO3 + 3NH3 + H2O → 2Ag + 2NH4NO3 + NH4OCOOC2H5 gồm điều kiện phản ứng, cách thực hiện, hiện tượng phản ứng và một số bài tập liên quan giúp các em củng cố toàn bộ kiến thức và rèn luyện kĩ năng làm bài tập về phương trình phản ứng hóa học. Mời các bạn đón xem:
Phương trình HCOOC2H5 + 2AgNO3 + 3NH3 + H2O → 2Ag + 2NH4NO3 + NH4OCOOC2H5
1. Phản ứng hóa học:
HCOOC2H5 + 2AgNO3 + 3NH3 + H2O 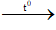
2. Điều kiện phản ứng
- Phản ứng xảy ra khi đun nóng.
3. Cách thực hiện phản ứng
- Cho HCOOC2H5 vào dung dịch bạc nitrat trong amoniac, thấy có kết tủa (Ag) xuất hiện.
4. Hiện tượng nhận biết phản ứng
- Có kết tủa xuất hiện.
5. Tính chất hóa học
5.1. Tính chất hóa học của HCOOC2H5
a. Phản ứng thủy phân trong mỗi trường axit
HCOOC2H5 + H-OH 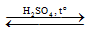
b. Phản ứng thủy phân trong mỗi trường kiềm
HCOOC2H5 + NaOH 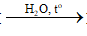
c. Phản ứng đốt cháy: Phản ứng oxi hóa hoàn toàn tạo CO2 và H2O
HCOOC2H5 + 7/2 O2 → 3CO2 + 3H2O
d. Tham gia vào phản ứng tráng bạc
HCOOC2H5 + 2AgNO3 + 3NH3 + H2O → 2Ag + 2NH4NO3 + NH4OCOOC2H5
5.2. Tính chất hóa học của AgNO3
- Mang tính chất hóa học của muối
a. Tác dụng với muối
AgNO3 + NaCl →AgCl↓+ NaNO3
2AgNO3 + BaCl2 →2AgCl↓+ Ba(NO3)2
b. Tác dụng với kim loại:
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag
c. Tác dụng với axit:
AgNO3 + HI → AgI ↓ + HNO3
Oxi hóa được muối sắt (II)
Fe(NO3)2 + AgNO3 → Fe(NO3)3 + Ag
5.3. Tính chất hóa học của NH3
a. Tính bazơ yếu
- Tác dụng với nước:
NH3 + H2O ⇋ NH4+ + OH-
⇒ Dung dịch NH3 là một dung dịch bazơ yếu.
- Tác dụng với dung dịch muối (muối của những kim loại có hidroxit không tan):
AlCl3 + 3NH3 + 3H2O → Al(OH)3↓ + 3NH4Cl
Al3+ + 3NH3 + 3H2O → Al(OH)3↓ + 3NH4+
- Tác dụng với axit → muối amoni:
NH3 + HCl → NH4Cl (amoni clorua)
2NH3 + H2SO4 → (NH4)2SO4 (amoni sunfat)
b. Khả năng tạo phức
Dung dịch amoniac có khả năng hòa tan hiđroxit hay muối ít tan của một số kim loại, tạo thành các dung dịch phức chất.
Ví dụ:
* Với Cu(OH)2:
Cu(OH)2 + 4NH3 → [Cu(NH3)4](OH)2 (màu xanh thẫm)
* Với AgCl:
AgCl + 2NH3 → [Ag(NH3)2]Cl
Sự tạo thành các ion phức là do sự kết hợp các phân tử NH3 bằng các electron chưa sử dụng của nguyên tử nitơ với ion kim loại.
5.4. Tính chất hóa học của H2O
a. Nước tác dụng với kim loại
Nước tác dụng được với một số kim loại ở nhiệt độ thường như: Li, Na, K, Ca.. tạo thành bazo và khí H2.
2Na + 2H2O → 2NaOH + H2 ↑
2K + 2H2O → 2KOH + H2 ↑
Ca + 2H2O → Ca(OH)2 + H2 ↑
Nước tác dụng với oxit bazo tạo thành bazo tương ứng. Dung dịc bazo làm quỳ tím hóa xanh.
Na2O + H2O → 2NaOH
CaO + H2O → Ca(OH)2
Nước tác dụng với oxit axit tạo thành axit tương ứng. Dung dịch axit làm quỳ tím hóa đỏ.
SO2 + H2O → H2SO3
P2O5 + 3H2O → 2H3PO4
6. Bạn có biết
- Chỉ có este tạo bởi HCOOH mới có phản ứng với AgNO3/NH3 để tạo kết tủa Ag.
- Phản ứng này dung để phân biệt este tạo bởi HCOOH với các este khác.
7. Bài tập liên quan
Ví dụ 1: Chất nào sao đây có thể tạo kết tủa với dung dịch AgNO3/NH3 ?
A. Metyl axetat.
B. Etyl axetat.
C. Etyl fomat.
D. But – 2 – in.
Hướng dẫn
etyl fomat là este tạo bởi HCOOH nên có thể phản ứng với AgNO3/NH3 tạo kết tủa.
Đáp án C.
Ví dụ 2: Cho 0,05 mol etyl axetat phản ứng hoàn toàn với một lượng dư AgNO3/NH3. Sau phản ứng thu được bao nhiêu mol Ag?
A. 0,1.
B. 0,2.
C. 0,3.
D. 0,4.
Hướng dẫn
Đáp án A.
Ví dụ 3: HCOOC2H5 có thể tham gia phản ứng với các chất nào sau đây?
A. Ag.
B. HCOOH.
C. AgNO3/NH3.
D. HCOOCH3.
Hướng dẫn
etyl fomat là este tạo bởi HCOOH nên có thể phản ứng với AgNO3/NH3
Đáp án C.
8. Một số phương trình phản ứng hoá học khác của Este và hợp chất: