Với giải Vận dụng trang 19 Hóa học lớp 10 Chân trời sáng tạo chi tiết trong Bài 2: Thành phần của nguyên tử giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 10. Mời các bạn đón xem:
Giải bài tập Hóa học lớp 10 Bài 2: Thành phần của nguyên tử
Vận dụng trang 19 Hóa học 10: Sử dụng sơ đồ tư duy để mô tả cấu tạo nguyên tử và hệ thống hóa kiến thức của bài học
Phương pháp giải:
- Nội dung chính bài học:
+ Cấu tạo nguyên tử
+ Kích thước nguyên tử, hạt nhân
+ Khối lượng của proton, electron, neutron => Khối lượng nguyên tử
Lời giải:
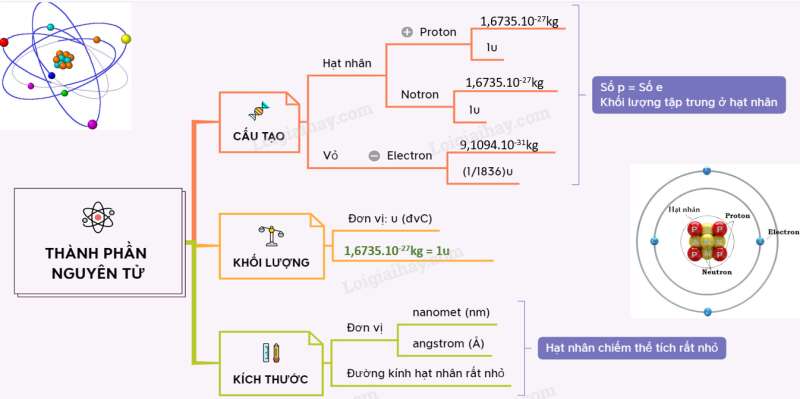
Lý thuyết Kích thước và khối lượng nguyên tử
1. Kích thước nguyên tử
- Đường kính của nguyên tử lớn hơn đường kính của hạt nhân khoảng 10 000 lần.
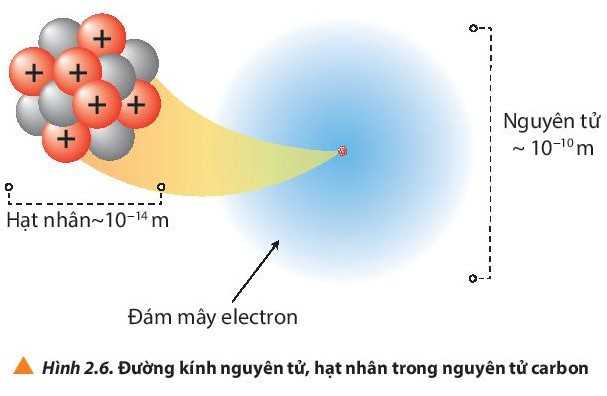
- Đơn vị nanomet (nm) hay angstrom () thường được sử dụng để biểu thị kích thước nguyên tử.
2. Khối lượng nguyên tử
- Để biểu thị khối lượng nguyên tử, các hạt proton, neutron và electron, người ta dùng đơn vị khối lượng nguyên tử, kí hiệu là amu.
1 amu bằng khối lượng nguyên tử của carbon – 12
1 amu = 1,66 × 10-24g.
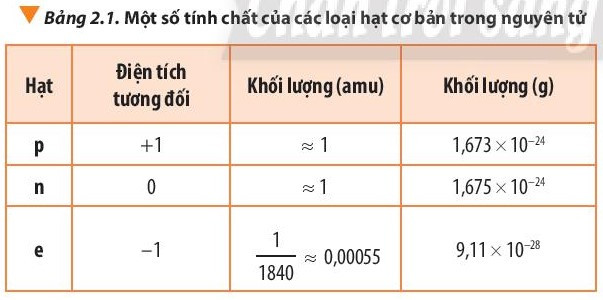
- Khối lượng của nguyên tử gần bằng khối lượng hạt nhân do khối lượng của các electron (me ≈ 0,00055 amu) không đáng kể so với khối lượng của proton (mp ≈ 1 amu) và neutron (mn ≈ 1 amu).
- Cách tính: Khối lượng nguyên tử = số p + số n
Ví dụ: Nguyên tử oxygen có 8 proton, 8 neutron và 8 electron.
⇒ Khối lượng nguyên tử oxygen = số p + số n = 8 + 8 = 16 amu.
Xem thêm các bài giải Hóa học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Câu hỏi 2 trang 14 Hóa học 10: Cho biết vai trò của màn huỳnh quang trong thí nghiệm ở Hình 2.2...
Bài 2 trang 19 Hóa học 10: Thông tin nào sau đây không đúng?...
Bài 3 trang 19 Hóa học 10: Mỗi phát biểu dưới đây mô tả loại hạt nào trong nguyên tử?...
Bài 4 trang 19 Hóa học 10: a) Cho biết 1g electron có bao nhiêu hạt...
Xem thêm các bài giải SGK Hóa học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Bài 2: Thành phần của nguyên tử
Bài 4: Cấu trúc lớp vỏ electron của nguyên tử
Bài 5: Cấu tạo bảng tuần hoàn các nguyên tố hóa học