Với giải Câu hỏi 6 trang 16 Hóa học lớp 10 Chân trời sáng tạo chi tiết trong Bài 2: Thành phần của nguyên tử giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 10. Mời các bạn đón xem:
Giải bài tập Hóa học lớp 10 Bài 2: Thành phần của nguyên tử
Câu hỏi 6 trang 16 Hóa học 10: Điện tích của hạt nhân nguyên tử do thành phần nào quyết định? Từ đó, rút ra nhận xét về mối quan hệ giữa số đơn vị điện tích hạt nhân và số proton
Phương pháp giải:
- Hạt nhân gồm 2 hạt:
+ Proton mang điện tích dương: +1
+ Neutron không mang điện
Lời giải:
- Hạt nhân gồm 2 hạt:
+ Proton mang điện tích dương: +1
+ Neutron không mang điện
- Hạt nhân nguyên tử mang điện tích dương
=> Điện tích của hạt nhân nguyên tử do hạt proton quyết định
=> Số đơn vị điện tích hạt nhân = số proton trong hạt nhân
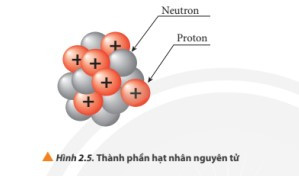
Lý thuyết Cấu tạo hạt nhân nguyên tử
- Vào năm 1918, khi bắn phá hạt nhân nguyên tử nitrogen bằng các hạt α, Rutherford đã nhận thấy sự xuất hiện hạt nhân nguyên tử oxygen và một loại hạt mang một đơn vị điện tích dương (eo hay +1), đó là proton (kí hiệu là p).
- Năm 1932, khi dùng các hạt α để bắn phá hạt nhân nguyên tử beryllium, J. Chadwick nhận thấy sự xuất hiện của một loại hạt có khối lượng xấp xỉ hạt proton, nhưng không mang điện. Ông gọi chúng là neutron (kí hiệu là n).
- Kết luận: Hạt nhân nguyên tử gồm hai loại hạt là proton và neutron.
+ Proton kí hiệu là p, mang điện tích dương (+1)
+ Neutron kí hiệu là n, không mang điện.
+ Proton và neutron có khối lượng gần bằng nhau.
Xem thêm các bài giải Hóa học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Câu hỏi 2 trang 14 Hóa học 10: Cho biết vai trò của màn huỳnh quang trong thí nghiệm ở Hình 2.2...
Bài 2 trang 19 Hóa học 10: Thông tin nào sau đây không đúng?...
Bài 3 trang 19 Hóa học 10: Mỗi phát biểu dưới đây mô tả loại hạt nào trong nguyên tử?...
Bài 4 trang 19 Hóa học 10: a) Cho biết 1g electron có bao nhiêu hạt...
Xem thêm các bài giải SGK Hóa học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Bài 2: Thành phần của nguyên tử
Bài 4: Cấu trúc lớp vỏ electron của nguyên tử
Bài 5: Cấu tạo bảng tuần hoàn các nguyên tố hóa học