Tailieumoi.vn xin giới thiệu phương trình CH3-CH=CH2+ H2 → CH3–CH2–CH3 gồm điều kiện phản ứng, cách thực hiện, hiện tượng phản ứng và một số bài tập liên quan giúp các em củng cố toàn bộ kiến thức và rèn luyện kĩ năng làm bài tập về phương trình phản ứng hóa học. Mời các bạn đón xem:
Phương trình CH3-CH=CH2+ H2 → CH3–CH2–CH3
1. Phản ứng hóa học:
CH3-CH=CH2 + H2 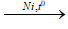
2. Điều kiện phản ứng
- Đun nóng, xúc tác niken (hoặc platin hoặc palađi).
3. Cách thực hiện phản ứng
- Đun nóng hỗn hợp propilen và H2 với xúc tác niken, propilen kết hợp với H2 thành propan (C3H8).
4. Hiện tượng nhận biết phản ứng
- Sản phẩm sinh ra không làm mất màu dung dịch brom.
5. Tính chất hóa học
5.1. Tính chất hóa học của Propen (C3H6)
a. Phản ứng cộng
- Hướng phản ứng cộng axit và nước vào anken.
Phản ứng cộng axit hoặc nước vào propen thường tạo ra hỗn hợp 2 đồng phân, trong đó 1 đồng phân là sản phẩm chính.
- Cộng Brom
- Phản ứng cộng hiđro (phản ứng hiđro hóa)
b. Phản ứng trùng hợp
- Propen trong điều kiện nhiệt độ, áp xuất, xúc tác thích hợp thì tham gia phản ứng cộng nhiều phân tử với nhau thành những phân tử mạch rất dài và có khối lượng phân tử rất lớn. Người ta gọi đó là phản ứng trùng hợp.
c. Phản ứng oxi hóa
- Propen cháy hoàn toàn tạo ra CO2, H2O và tỏa nhiều nhiệt:
C3H6 + O2 → 3CO2 + 3H2O
- Propen làm mất màu dung dịch KMnO4:
3C3H6 + 2KMnO4 + 4H2O → 2KOH + 2MnO2 + 3C3H6(OH)2
- Phản ứng làm mất màu dung dịch thuốc tím kali pemanganat được dùng để nhận ra sự có mặt của liên kết đôi của anken.
5.2. Tính chất hóa học của H2
Hiđro là phi kim có tính khử. Ở những nhiệt độ thích hợp, hiđro không những kết hợp được với đơn chất oxi mà còn kết hợp được với nguyên tố oxi trong một số oxit kim loại. Các phản ứng này đều tỏa nhiều nhiệt. Cụ thể:
- Hiđro tác dụng với oxi
Hiđro cháy trong oxi theo phương trình hóa học:
Hỗn hợp H2 và O2 là hổn hợp nổ. Hỗn hợp nổ mạnh nhất khi tỉ lệ H2 : O2 là 2:1 về thể tích.
- Hiđro tác dụng với một số oxit kim loại như FeO, CuO, Fe2O3, …
Ví dụ:
Hiđro phản ứng với đồng oxit ở nhiệt độ khoảng 400°C theo phương trình hóa học:
6. Bạn có biết
- Phản ứng trên gọi là phản ứng cộng.
- Tương tự propen, các anken khác cũng tác dụng với H2 với xúc tác niken thành ankan tương ứng.
- Tỉ lệ phản ứng luôn là 1:1
- Khối lượng trước và sau phản ứng luôn bằng nhau
- Số mol sau phản ứng luôn giảm → Số mol H2 phản ứng = nđ - ns
7. Bài tập liên quan
Ví dụ 1: Hỗn hợp khí X gồm 0,3 mol H2 và 0,1 mol propen. Nung X một thời gian với xúc tác Ni thu được hỗn hợp khí Y có tỉ khối so với H2 là 16. Tính số mol H2 phản ứng?
A. 0,15 mol
B. 0,2 mol
C. 0,25 mol
D. 0,3 mol
Hướng dẫn:
Đáp án C.
Ví dụ 2: Hỗn hợp khí X gồm H2 và C3H6 có tỉ khối so với H2 là 5,5. Dẫn X qua Ni nung nóng, thu được hỗn hợp khí Y có tỉ khối so với He là 7,33. Hiệu suất của phản ứng hiđro hoá là:
A. 25%
B. 20%
C. 50%
D. 40%
Hướng dẫn
Giả sử trong 1 mol X có x mol H2 và y mol C3H6
⇒ x + y = 1 mol;
mhh = 2x + 42y = 5,5.4.1 = 22
⇒ x = y = 0,5 mol.
Do phản ứng trong bình kín nên bảo toàn khối lượng
Đáp án D.
Ví dụ 3: Hỗn hợp X gồm H2, C2H4 và C3H6 có tỉ khối so với H2 là 9,25. Cho 22,4 lít X (đktc) vào bình kín có sẵn một ít bột Ni. Đun nóng bình một thời gian, thu được hỗn hợp khí Y có tỉ khối so với H2 bằng 10. Tổng số mol H2 đã phản ứng là
A. 0,070 mol
B. 0,015 mol
C. 0,075 mol
D. 0,050 mol
Hướng dẫn
mX = 18,5.1 = 18,5 g;
nY = 18,5/20 = 0,925 mol
⇒ nH2 pư = 1 – 0,925 = 0,075 mol
Đáp án C.
Ví dụ 4: Áp dụng quy tắc Maccopnhicop vào trường hợp nào sau đây?
A. Phản ứng cộng của Br2 với anken đối xứng.
C. Phản ứng cộng của HX vào anken đối xứng.
B. Phản ứng trùng hợp của anken.
D. Phản ứng cộng của HX vào anken bất đối xứng.
Hướng dẫn
Đáp án D.
Ví dụ 5: Khi cho but-1-en tác dụng với dung dịch HBr, theo qui tắc Maccopnhicop sản phẩm nào sau đây là sản phẩm chính?
A. CH3-CH2-CHBr-CH2Br.
C. CH3-CH2-CHBr-CH3.
B. CH2Br-CH2-CH2-CH2Br
D. CH3-CH2-CH2-CH2Br.
Hướng dẫn
Đáp án C
Ví dụ 6: Hỗn hợp X gồm 3 khí C3H4, C2H2 và H2 cho vào bình kín dung tích 8,96 lít (đktc) chứa bột Ni, nung nóng bình một thời gian thu được hỗn hợp khí Y. Biết tỉ khối của X so với Y là 0,75. Số mol H2 tham gia phản ứng là
A. 0,75 mol
B. 0,30 mol
C. 0,10 mol
D. 0,60 mol
Hướng dẫn
nX = 0,4 mol
Ta có: dX/Y= MY=nY/nX = nY/0,4= 0,75 ⇒ nY = 0,3 (mol)
=> nH2 phản ứng = ngiảm = nX – nY = 0,4 – 0,3 = 0,1 mol
Đáp án C
8. Một số phương trình phản ứng hóa học khác của Anken và hợp chất
CH2=CH–CH3 + Br2 → CH2Br–CHBr–CH3
CH2=CH–CH3 + Cl2 → CH2Cl–CHCl– CH3
CH2=CH–CH3 + HCl → CH3–CHCl–CH3
CH2=CH–CH3 + HBr → CH3-CHBr–CH3
CH2=CH–CH3 + H2O → CH3-CHOH–CH3