Tailieumoi.vn xin giới thiệu phương trình NaAlO2 + CO2 + 2H2O → Al(OH)3↓ + NaHCO3 gồm điều kiện phản ứng, cách thực hiện, hiện tượng phản ứng và một số bài tập liên quan giúp các em củng cố toàn bộ kiến thức và rèn luyện kĩ năng làm bài tập về phương trình phản ứng hóa học của Nhôm. Mời các bạn đón xem:
Phương trình NaAlO2 + CO2 + 2H2O → Al(OH)3↓ + NaHCO3
1. Phương trình phản ứng hóa học:
NaAlO2 + CO2 + 2H2O → Al(OH)3↓ + NaHCO3
2. Hiện tượng nhận biết phản ứng
- Phản ứng tạo kết tủa keo trắng Al(OH)3.
3. Điều kiện phản ứng
- Điều kiện thường.
4. Tính chất hoá học
a. Tính chất hoá học của muối Aluminat (AlO2-)
- Tác dụng với axit:
2H2O + NaAlO2 + CO2 → Al(OH)3↓ + NaHCO3
H2O + HCl + NaAlO2 → Al(OH)3↓ + NaCl
Ba(AlO2)2 + 4H2SO4 → Al2(SO4)3 + 4H2O + BaSO4↓
5. Cách thực hiện phản ứng
- Sục khí CO2 vào dung dịch NaAlO2 tạo kết tủa Al(OH)3 và dung dịch muối NaHCO3.
6. Bạn có biết
- Kết tủa Al(OH)3 không bị hòa tan khi CO2 dư, do muối Al2(CO3) không tồn tại.
7. Bài tập liên quan
Ví dụ 1: Cho sơ đồ phản ứng trong dung dịch:
NaAlO2 + X(dư) → Al(OH)3 + ….
Chất X là:
A. NH3.
B. CO2.
C. KOH.
D. H2SO4.
Hướng dẫn giải
Chọn B.
Giải thích: NaAlO2 + CO2 + 2H2O → Al(OH)3↓ + NaHCO3
Ví dụ 2: Sục CO2 đến dư vào dung dịch NaAlO2 có hiện tượng gì?
A. Tạo kết tủa keo trắng, kết tủa tan khi CO2 dư.
B. Tạo kết tủa keo trắng, kết tủa không tan khi CO2 dư.
C. Tạo dung dịch trong suốt.
D. Không có hiện tượng gì xảy ra.
Hướng dẫn giải
Chọn B.
Giải thích: NaAlO2 + CO2 + 2H2O → Al(OH)3↓ + NaHCO3
Kết tủa keo trắng là Al(OH)3.
Ví dụ 3: Có gì giống khi cho khí CO2 và dung dịch HCl loãng tác dụng với dung dịch NaAlO2?
A. Đều có khí xuất hiện.
B. Đều có kết tủa xuất hiện.
C. Đều có kết tủa keo trắng xuất hiện.
D. Đều không có hiện tượng gì xảy ra.
Hướng dẫn giải
Chọn C.
- Kết tủa xuất hiện, không tan trong CO2 dư:
NaAlO2 + CO2 + 2H2O → Al(OH)3↓ + NaHCO3
- Kết tủa xuất hiện rồi tan trong dung dịch HCl dư:
NaAlO2 + HCl + H2O → Al(OH)3↓ + NaCl
3HCl + Al(OH)3 → AlCl3 + 3H2O
Ví dụ 4: Sục khí CO2 đến dư vào dung dịch NaAlO2 hiện tượng xảy ra là
A. Không có hiện tượng gì.
B. có kết tủa keo trắng, sau đó kết tủa lại tan.
C. có kết tủa keo trắng.
D. dung dịch vẫn trong suốt.
Hướng dẫn giải
Chọn C.
Ví dụ 5: Sục khí CO2 vào dung dịch NaAlO2
A. Không có hiện tượng gì
B. Dung dịch vẩn đục
C. Dung dịch trong suốt sau bị vẩn đục
D. Dung dịch có màu trong suốt
Hướng dẫn giải
Chọn B.
Giải thích: Có kết tủa keo trắng không tan.
NaAlO2 + CO2 + 2H2O → Al(OH)3↓ + NaHCO3.
Ví dụ 6: Dãy nào dưới đây gồm các chất vừa tác dụng với dung dịch axit HCl vừa tác dụng với dung dịch kiềm NaOH?
A. AlCl3 và Al2(SO4)3.
B. Al(NO3)3 và Al(OH)3.
C. Al2(SO4)3 và Al2O3.
D. Al(OH)3 và Al2O3.
Hướng dẫn giải
Chọn D.
Ví dụ 7: Khi cho từ từ khí CO2 đến dư vào dung dịch NaAlO2. Hiên tượng quan sát được là
A. xuất hiện kết tủa keo trắng
B. lúc đầu xuất hiện kết tủa keo trắng sau đó kết tủa tan hết.
C. không có hiện tượng gì xảy ra
D. xuất hiện kết tủa keo trắng, sau đó kết tủa bị hoà tan một phần.
Hướng dẫn giải
Chọn A.
Khi cho từ từ khí CO2 đến dư vào dung dịch NaAlO2. Hiên tượng quan sát được là xuất hiện kết tủa keo trắng
Ví dụ 8: Cho các thí nghiệm sau
(1) Cho Ba vào dung dịch chứa phèn chua
(2) Cho FeCl2 vào dung dịch AgNO3
(3) Cho Ca(OH)2 vào Mg(HCO3)2
(4) Sục khí NH3 vào dung dịch hỗn hợp CuCl2 và AlCl3
(5) Cho một miếng nhôm vào dung dịch NaOH dư rồi sục khí CO2 vào
Tổng số thí nghiệm có khả năng tạo kết tủa là:
A. 2
B. 5
C. 3
D. 4
Hướng dẫn giải
Chọn B.
Giải thích: (1) tạo kết tủa BaSO4 có thể có thêm Al(OH)3
Ba + 2H2O → Ba(OH)2 + H2↑
Ba2+ + SO42- → BaSO4↓ + H2O
Al3+ + 3OH- → Al(OH)3↓
(2) tạo kết tủa AgCl và Ag
FeCl2 + 2AgNO3 → 2AgCl↓ + Fe(NO3)2
Fe(NO3)2 + AgNO3 → Ag↓ + Fe(NO3)3
(3) tạo kết tủa CaCO3 và MgCO3
Ca(OH)2 + Mg(HCO3)2 → CaCO3↓ + MgCO3↓ + 2H2O
(4) tạo Al(OH)3 có thể có Cu(OH)2
NH3 + H2O + AlCl3 → Al(OH)3↓ + NH4Cl
NH3 + H2O + CuCl2 → Cu(OH)2↓ + NH4Cl
4NH3 + Cu(OH)2 → Cu(NH3)4(OH)2 phức tan
(5) tạo kết tủa Al(OH)3 không tan trong CO2
Al + NaOH + H2O → NaAlO2 + 3/2H2↑
Ví dụ 9: Nhận định nào sau đây không đúng khi nhắc về kim loại kiềm?
A. Đều có cấu tạo mạng tinh thể giống nhau: lập phương tâm khối
B. Kim loại kiềm là những nguyên tố mà nguyên tử có 1 e ở phân lớp p
C. Kim loại kiềm fễ bị oxi hóa
D. Năng lượng ion hóa thứ nhất của các nguyên tử kim loại kiềm thấp hơn so với các nguyên tố khác trong cùng chu kì
Hướng dẫn giải
Chọn B.
Ví dụ 10: Sục từ từ khí CO2 đến dư vào dung dịch hỗn hợp chứa Ca(OH)2 và NaAlO2. Khối lượng kết tủa thu được sau phản ứng được biểu diễn trên đồ thị sau:
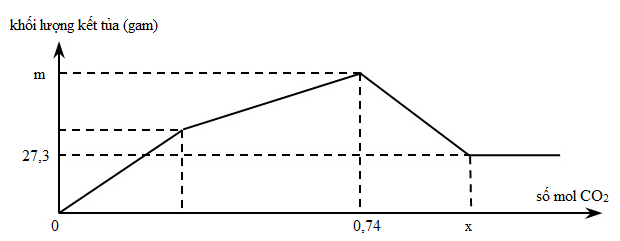
Giá trị của m và x là
A. 66,3 và 1,31.
B. 66,3 và 1,13.
C. 39,0 và 1,31.
D. 39,0 và 1,13.
Hướng dẫn giải
Chọn B.
Giải thích: mAl(OH)3 = 27,3 gam => nAl(OH)3 = nAlO2- = 0,35 mol
Thứ tự phản ứng:
(1) CO2 + 2H2O + AlO2- → Al(OH)3 + HCO3-
(2) CO2 + Ca(OH)2 → CaCO3 + H2O
(3) CO2 + CaCO3 + H2O → Ca(HCO3)2
Tại nCO2 = 0,74 mol thì cả Al(OH)3 và CaCO3 đạt giá trị lớn nhất, phản ứng (2) vừa kết thúc:
nCO2= nAlO2- + nCa(OH)2 => 0,74 = 0,35 + nCa(OH)2 => nCa(OH)2 = 0,39 mol
=> m = mCaCO3+ mAl(OH)3 = 0,39.100 + 0,35.78 = 66,3 gam
- Tại nCO2 = x: CaCO3 bị hòa tan hết, phản ứng (3) vừa kết thúc
x = nCO2 = nAlO2- + 2nCa(OH)2 = 0,35 + 2.0,39 = 1,13 mol
Ví dụ 11: Cho các chất: Al(OH)3; NaAlO2; Al2O3; Zn(OH)2; Mg(OH)2; ZnO; SO2; NaHCO3; K2HPO4; KHS; KHSO3; Na2ZnO2; AgNO3 và Fe(OH)3. Có mấy chất trong dãy có tính chất lưỡng tính:
A. 7
B. 8
C. 9
D. 10
Hướng dẫn giải
Chọn B.
Giải thích: Các chất có tính lưỡng tính là: Al(OH)3; Al2O3; Zn(OH)2; ZnO; NaHCO3; K2HPO4; KHS; KHSO3.
8. Một số phương trình phản ứng hoá học khác của Nhôm (Al) và hợp chất:
NaAlO2 + HCl + H2O → Al(OH)3↓ + NaCl
NaAlO2 + 4HCl → AlCl3 + 2H2O + NaCl
2NaAlO2 + 4H2SO4 → Al2(SO4)3 + 4H2O + Na2SO4
NaAlO2 + NaHSO4 + H2O → Al(OH)3↓ + Na2SO4
KAlO2 + CO2 + 2H2O → Al(OH)3↓ + KHCO3
KAlO2 + 4HCl → AlCl3 + 2H2O + KCl
KAlO2 + HCl + H2O → Al(OH)3↓ + KCl