Với giải Bài 17.21 trang 77 SBT Hóa học lớp 10 Chân trời sáng tạo chi tiết trong Bài 17: Tính chất vật lí và hóa học các đơn chất nhóm VIIA giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập trong SBT Hóa học 10. Mời các bạn đón xem:
Giải sách bài tập Hóa học lớp 10 Bài 17: Tính chất vật lí và hóa học các đơn chất nhóm VIIA
Bài 17.21 trang 77 SBT Hóa học 10. Tại sao trong hợp chất của halogen, nguyên tố fluorine chỉ thể hiện số oxi hóa – 1, còn các nguyên tố chlorine, bromine, iodine là – 1, + 1, + 3, + 5, + 7?
Lời giải:
Cấu hình electron lớp ngoài cùng của nguyên tử halogen ns2np5, có 1 electron không ghép đôi; chlorine, bromine, iodine tạo hợp chất có mức oxi hoá -1 khi liên kết với nguyên tử có độ âm điện nhỏ hơn như kim loại, hydrogen, ... và tạo mức oxi hoá +1 khi liên kết với nguyên tử có độ âm điện lớn hơn như oxygen, fluorine, ...
Ngoài ra, chlorine, bromine, iodine còn các ô lượng tử chưa lấp đầy, có thể xảy ra các quá trình kích thích electron lên phân mức năng lượng cao hơn, tạo ra mức oxi hoá +3, +5, +7.
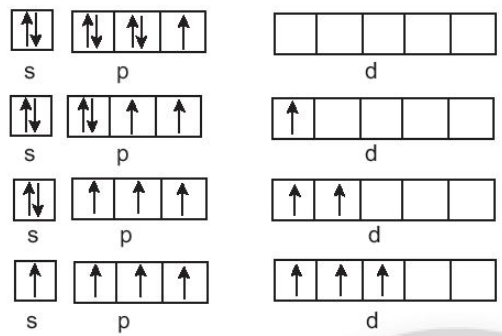
Cấu hình elecron của fluorine là 1s22s22p5, ở lớp elecron ngoài cùng có 1 electron không ghép đôi, không có ô lượng tử trống, khi hình thành liên kết hoá học, không có nguyên tử nào có độ âm điện lớn hơn fluorine đủ để cung cấp năng lượng cho quá trình kích thích, vì vậy, fluorine chỉ thể hiện mức oxi hoá -1 trong các hợp chất.
Xem thêm các bài giải SBT Hoá học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Bài 17.1 trang 75 SBT Hóa học 10. Trong bảng tuần hoàn các nguyên tố hóa học, halogen thuộc nhóm
Bài 17.2 trang 75 SBT Hóa học 10. Halogen tồn tại thể lỏng ở điều kiện thường là
Bài 17.3 trang 75 SBT Hóa học 10. Đơn chất halogen ở thể khí, màu vàng lục là
Bài 17.4 trang 75 SBT Hóa học 10. Nguyên tố có tính oxi hóa yếu nhất thuộc nhóm VIIA là:
Bài 17.5 trang 75 SBT Hóa học 10. Cấu hình electron nguyên tử thuộc nguyên tố halogen là:
Bài 17.6 trang 75 SBT Hóa học 10. Ứng dụng nào sau đây không phải của Cl2?
Bài 17.7 trang 75 SBT Hóa học 10. Halogen nào được dùng trong sản xuất nhựa Teflon?
Bài 17.8 trang 75 SBT Hóa học 10. Nguyên tố halogen được dùng trong sản xuất nhựa PVC là:
Bài 17.11 trang 76 SBT Hóa học 10. Halogen nào tạo liên kết ion bền nhất với sodium?
Bài 17.12 trang 76 SBT Hóa học 10. Liên kết trong phân tử đơn chất halogen là:
Bài 17.13 trang 76 SBT Hóa học 10. Theo chiều từ F → Cl → Br → I, bán kính của nguyên tử
Bài 17.14 trang 76 SBT Hóa học 10. Đặc điểm của halogen là:
Bài 17.15 trang 76 SBT Hóa học 10. Phát biểu nào sau đây là không đúng?
Bài 17.16 trang 76 SBT Hóa học 10. Giá trị độ âm điện của halogen và hydrogen trong bảng sau:
Bài 17.17 trang 76 SBT Hóa học 10. Cho phương trình hóa học của 2 phản ứng như sau:
Bài 17.24 trang 77 SBT Hóa học 10. Một học sinh thực hiện thí nghiệm và cho kết quả như sau:
Bài 17.25 trang 77 SBT Hóa học 10. Xác nhận đúng, sai cho các phát biểu trong bảng sau:
Xem thêm các bài giải SBT Hoá học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Bài 16: Các yếu tố ảnh hưởng đến tốc độ phản ứng hóa học
Bài 17: Tính chất vật lí và hóa học các đơn chất nhóm VIIA