Với Giải hóa học lớp 10 trang 98 Cánh diều chi tiết giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 10. Mời các bạn đón xem:
Giải hóa học 10 trang 98 Cánh diều
Bài 1 trang 98 Hóa học 10: Nồi áp suất dùng để ninh, hầm thức ăn có thể làm nóng nước tới nhiệt độ 120oC so với 100oC khi dùng nồi thường. Trong quá trình hầm xương thường diễn ra nhiều phản ứng hóa học, ví dụ quá trình biến đổi các protein, chẳng hạn như thủy phân một phần collagen thành gelatin. Hãy cho biết tốc độ quá trình thủy phân collagen thành gelatin thay đổi như thế nào khi sử dụng nồi áp suất thay cho nồi thường
A. Không thay đổi
B. Giảm đi 4 lần
C. Ít nhất tăng 4 lần
D. Ít nhất giảm 16 lần
Phương pháp giải:

Lời giải:

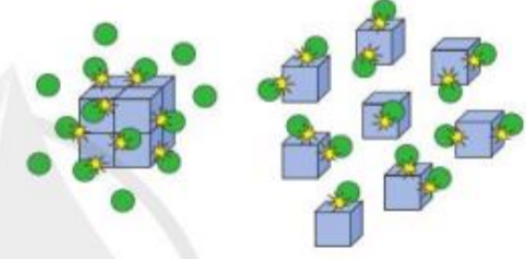
Bài 2 trang 98 Hóa học 10: Hình ảnh bên minh họa ảnh hưởng của yếu tố nào tới tốc độ phản ứng? Giải thích
Phương pháp giải:
Các yếu tố ảnh hưởng đến tốc độ phản ứng: nồng độ, áp suất, diện tích bề mặt, nhiệt độ, chất xúc tác
Lời giải:
- Hình thứ nhất mô tả: chất tham gia ở dạng khối lớn
- Hình thứ hai mô tả: chất tham gia được chia nhỏ ra
=> Tăng diện tích tiếp xúc bề mặt giữa các chất tham gia
=> Hình ảnh mô tả ảnh hưởng của diện tích bề mặt đến tốc độ phản ứng
Bài 3 trang 98 Hóa học 10: Khí H2 có thể được điều chế bằng cách cho miếng sắt vào dung dịch HCl. Hãy đề xuất các biện pháp khác nhau để làm tăng tốc độ điều chế khí H2
Phương pháp giải:
Các yếu tố ảnh hưởng đến tốc độ phản ứng: nồng độ, áp suất, diện tích bề mặt, nhiệt độ, chất xúc tác
Lời giải:
- Các biện pháp khác nhau để làm tăng tốc độ điều chế khí H2 là:
+ Nồng độ: Tăng nồng độ của HCl
+ Áp suất: Không được vì chất tham gia không tồn tại ở dạng khí
+ Diện tích bề mặt: Cắt nhỏ miếng sắt
+ Nhiệt độ: Đun nóng dung dịch HCl
+ Chất xúc tác: Không có
Bài 4 trang 98 Hóa học 10: Cùng một lượng kim loại Zn phản ứng với cùng một thể tích dung dịch H2SO4 1M, nhưng ở hai nhiệt độ khác nhau.
Zn + H2SO4 → ZnSO4 + H2
Thể tích khí H2 sinh ra ở mỗi thí nghiệm theo thời gian được biểu diễn ở đồ thị bên
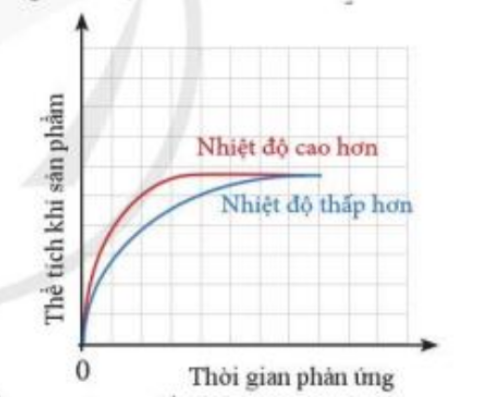
a) Giải thích vì sao đồ thị màu đỏ ban đầu cao hơn đồ thị màu xanh
b) Vì sao sau một thời gian, hai đường đồ thị lại chụm lại với nhau?
Phương pháp giải:
a) Nhiệt độ càng cao, tốc độ phản ứng diễn ra càng nhanh
b) Sau một thời gian, phản ứng diễn ra hoàn toàn, chất tham gia phản ứng hết
Lời giải:
a)
- Đường màu đỏ biểu diễn tốc độ phản ứng ở nhiệt độ cao hơn
- Đường màu xanh biểu diễn tốc độ phản ứng ở nhiệt độ thấp hơn
- Trong phản ứng hóa học, nhiệt độ càng cao, tốc độ phản ứng diễn ra càng nhanh
=> Đường màu đỏ ban đầu cao hơn đường màu xanh
b)
- Sau 1 thời gian, phản ứng diễn ra hoàn toàn, chất tham gia phản ứng hết
- Vì lượng chất tham gia là như nhau => Lượng chất sản phẩm tạo thành là bằng nhau
=> Sau một thời gian, hai đường đồ thị chụm lại với nhau (thể tích khí H2 là bằng nhau)
Bài 5 trang 98 Hóa học 10: Phản ứng A → sản phẩm được thực hiện trong bình kín. Nồng độ của A tại các thời điểm t = 0, t = 1 phút, t = 2 phút lần lượt là 0,1563M; 0,1496M; 0,1431M
a) Tính tốc độ trung bình của phản ứng trong phút thứ nhất và từ phút thứ nhất tới hết phút thứ hai
b) Vì sao hai giá trị tốc độ tính được không bằng nhau
Phương pháp giải:
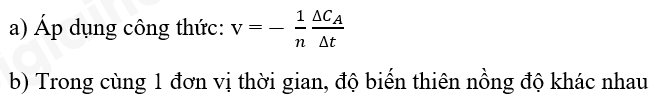
Lời giải:
a)

b)
- Ta nhận thấy, tốc độ phản ứng ở phút thứ nhất (v1) nhanh hơn tốc độ phản ứng ở phút thứ 2 (v2)
- Sau một khoảng thời gian bất kì, nồng độ chất tham gia giảm
Mà tốc độ phản ứng phụ thuộc vào nồng độ (nồng độ càng cao, tốc độ phản ứng càng nhanh)
=> Sau 1 khoảng thời gian phản ứng, tốc độ phản ứng giảm dần và không bằng nhau
Xem thêm các bài giải Hóa học lớp 10 Cánh diều tạo hay, chi tiết khác: