Với Giải hóa học lớp 10 trang 69 Cánh diều chi tiết giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 10. Mời các bạn đón xem:
Giải hóa học 10 trang 69 Cánh diều
Bài 1 trang 69 Hóa học 10: Liên kết hydrogen xuất hiện giữa những phân tử cùng loại nào sau đây?
A. CH4
B. NH3
C. H3C – O – CH3
D. PH3
Phương pháp giải:
Dựa vào khái niệm liên kết hydrogen: Liên kết hydrogen là một loại liên kết yếu được hình thành giữa nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn) với một nguyên tử khác (có độ âm điện lớn) còn cặp electron riêng. Các nguyên tố có độ âm điện lớn thường gặp trong liên kết hydrogen là N, O, F.
Lời giải:
Liên kết hydrogen xuất hiện giữa những phân tử cùng loại NH3:
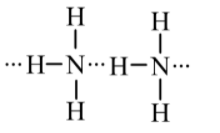
Đáp án: B
Bài 2 trang 69 Hóa học 10: Nhiệt độ nóng chảy và nhiệt độ sôi của hai chất HBr và HF như sau:
|
Chất |
Nhiệt độ nóng chảy (oC) |
Nhiệt độ sôi (oC) |
|
? |
–86,9 |
–66,8 |
|
? |
–83,6 |
19,5 |
Hãy gán công thức chất thích hợp vào các ô có dấu?
Phương pháp giải:
- So sánh nhiệt độ sôi, nhiệt độ nóng chảy của HBr và HF, nhiệt độ nóng chảy và nhiệt độ sôi của phân tử phụ thuộc vào 2 yếu tố:
+ Khối lượng phân tử: khối lượng càng lớn thì nhiệt độ nóng chảy, nhiệt độ sôi càng cao.
+ Liên kết giữa các phân tử: số lượng liên kết giữa các phân tử càng nhiều lực liên kết càng mạnh khi đó cần nhiệt độ nóng chảy, nhiệt độ sôi cao đẻ phá vỡ liên kết của chúng.
- Điền công thức thích hợp vào ô có dấu ?
Lời giải:
- Mặc dù HBr có khối lượng phân tử lớn hơn so với HF, nhưng nhiệt độ nóng chảy và nhiệt độ của HBr thấp hơn so với HF.
Do trong phân tử HF có các liên kết hydrogen, còn HBr không có liên kết hydrogen. Để phá vỡ được các liên kết hydrogen liên phân tử trong HF cần phải cung cấp năng lượng để phá vỡ liên kết và động năng để phân tử chuyển động nhiều hơn so với phân tử HBr. Khi đó nhiệt độ nóng chảy, nhiệt độ sôi của HF đều lớn hơn HBr.
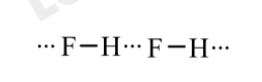
- Điền công thức thích hợp vào ô có dấu ?
|
Chất |
Nhiệt độ nóng chảy (oC) |
Nhiệt độ sôi (oC) |
|
HBr |
–86,9 |
–66,8 |
|
HF |
–83,6 |
19,5 |
Bài 3 trang 69 Hóa học 10: Chọn phương án đúng
1. Những phát biểu nào sau đây là đúng khi nói về các loại liên kết?
a) Liên kết hydrogen yếu hơn liên kết ion và liên kết cộng hóa trị.
b) Liên kết hydrogen mạnh hơn liên kết ion và liên kết cộng hóa trị.
c) Tương tác van der Waals yếu hơn liên kết hydrogen.
d) Tương tác van der Waals mạnh hơn liên kết hydrogen.
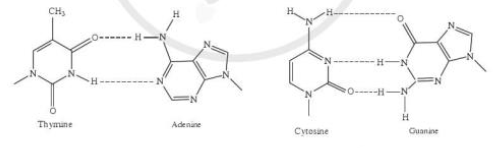
2. Các liên kết biểu diễn bằng các đường nét đứt có vai trò quan trọng trong việc làm bền chuỗi xoắn đôi DNA. Đó là loại liên kết gì?
A. Liên kết ion.
B. Liên kết cộng hóa trị có cực.
C. Liên kết cộng hóa trị không cực.
D. Liên kết hydrogen.
Phương pháp giải:
Dựa vào lý thuyết liên kết cộng hóa trị, liên kết ion, liên kết hydrogen và liên kết van der Waals.
Lời giải:
1. Những phát biểu đúng là:
a) Liên kết hydrogen yếu hơn liên kết ion và liên kết cộng hóa trị.
c) Tương tác van der Waals yếu hơn liên kết hydrogen.
2. Các liên kết biểu diễn bằng các đường nét đứt có vai trò quan trọng trong việc làm bền chuỗi xoắn đôi DNA. Đó là liên kết hydrogen.
Đáp án: D
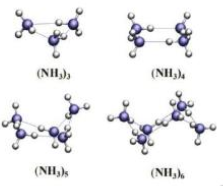
Bài 4 trang 69 Hóa học 10: Một kết quả nghiên cứu mới đây cho thấy các phân tử NH3 có thể liên kết với nhau thành những cụm phân tử (NH3)n với n = 3 – 6. (Theo ACD Omega 2020, 5, 49, 31724-31729)
Vì sao các phân tử NH3 có thể hình thành được cụm phân tử này?
Phương pháp giải:
Dựa vào lý thuyết liên kết hydrogen.
Lời giải:
Nhờ có liên kết hydrogen giữa các nguyên tử H liên kết với N trong phân tử NH3, các NH3 hình thành được các cụm phân tử (NH3)n với n = 3 – 6.
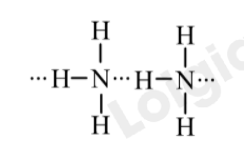
Xem thêm các bài giải Hóa học lớp 10 Cánh diều tạo hay, chi tiết khác: