Với Giải hóa học lớp 10 trang 51 Cánh diều chi tiết giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 10. Mời các bạn đón xem:
Giải hóa học 10 trang 51 Cánh diều
Luyện tập 2 trang 51 Hóa học 10: Hãy dự đoán xu hướng nhường, nhận electron của mỗi nguyên tử trong từng cặp nguyên tử sau. Vẽ mô hình (hoặc viết số electron theo lớp) quá trình các nguyên tử nhường, nhận electron để tạo ion
a) K (Z = 19) và O (Z = 8).
b) Li (Z = 3) và F (Z = 9).
c) Mg (Z = 12) và P (Z = 15)
Phương pháp giải:
- Các kim loại có 1, 2 hoặc 3 electron ở lớp ngoài cùng có xu hướng nhường bớt toàn bộ các electron này để tạo thành ion dương
- Các phi kim với 5, 6 hoặc 7 electron ở lớp ngoài cùng có xu hướng nhận thêm electron để đạt 8 electron ở lớp ngoài cùng
Lời giải:
a)
- K (Z = 19): 1s22s22p63s23p64s1 => Có 1 electron ở lớp vỏ ngoài cùng => Xu hướng nhường 1 electron
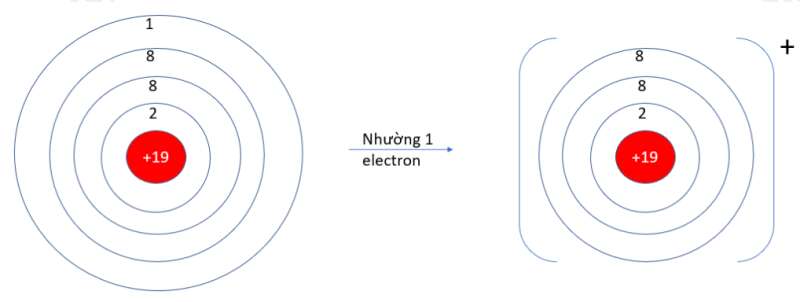
- O (Z = 8): 1s22s22p4 => Có 6 electron ở lớp vỏ ngoài cùng => Xu hướng nhận 2 electron

b)
- Li (Z = 3): 1s22s1 => Có 1 electron ở lớp vỏ ngoài cùng => Xu hướng nhường 1 electron
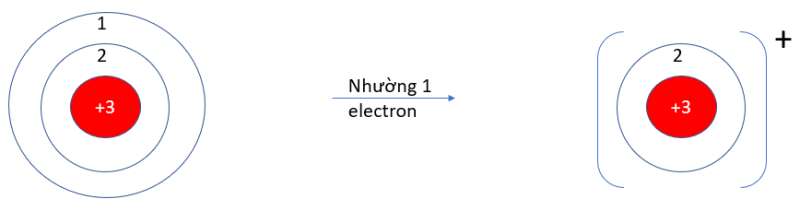
- F (Z = 9): 1s22s22p5 => Có 7 electron ở lớp vỏ ngoài cùng => Xu hướng nhận 1 electron
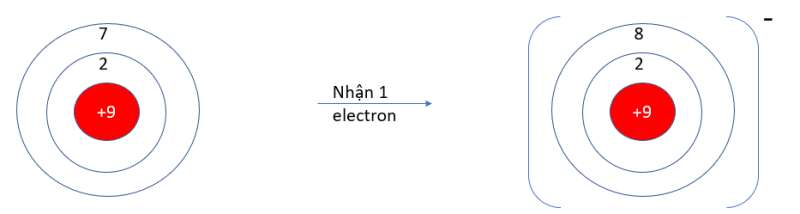
c)
- Mg (Z = 12): 1s22s22p63s2 => Có 2 electron ở lớp vỏ ngoài cùng => Xu hướng nhường 2 electron
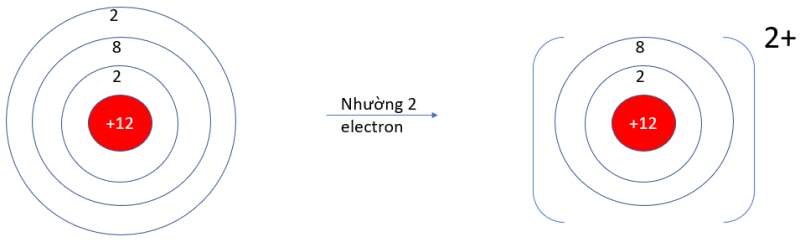
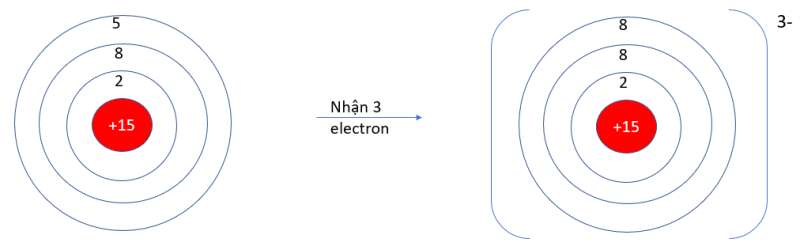
- P (Z = 15): 1s22s22p63s23p3 => Có 5 electron ở lớp vỏ ngoài cùng => Xu hướng nhận 3 electron
Luyện tập 3 trang 51 Hóa học 10: Vì sao các nguyên tố thuộc chu kì 2 chỉ có tối đa 8 electron ở lớp ngoài cùng (thỏa mãn quy tắc 8 electron khi tham gia liên kết)?
Phương pháp giải:
Chu kì 2 có 2 phân lớp: phân lớp s và phân lớp p
Lời giải:
- Chu kì 2 có 2 phân lớp đó là: phân lớp s và phân lớp p
- Phân lớp s chứa tối đa 2 electron, phân lớp p chứa tối đa 6 electron
=> Chu kì 2 chỉ chứa được tối đa 8 electron
Xem thêm các bài giải Hóa học lớp 10 Cánh diều tạo hay, chi tiết khác: