Với Giải hóa học lớp 10 trang 52 Cánh diều chi tiết giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 10. Mời các bạn đón xem:
Giải hóa học 10 trang 52 Cánh diều
Bài 1 trang 52 Hóa học 10: Nguyên tử nitrogen và nguyên tử nhôm có xu hướng nhận hay nhường lần lượt bao nhiêu electron để đạt được cấu hình electron bền vững?
A. Nhận 3 electron, nhường 3 electron
B. Nhận 5 electron, nhường 5 electron
C. Nhường 3 electron, nhận 3 electron
D. Nhường 5 electron, nhận 5 electron
Phương pháp giải:
Bước 1: Viết cấu hình electron của nitrogen (Z = 7) và nhôm (Z = 13)
Bước 2: Dựa vào số electron ở lớp vỏ ngoài cùng => Nguyên tử có xu hướng nhường hay nhận electron
- Các kim loại có 1, 2 hoặc 3 electron ở lớp ngoài cùng có xu hướng nhường bớt toàn bộ các electron này để tạo thành ion dương
- Các phi kim với 5, 6 hoặc 7 electron ở lớp ngoài cùng có xu hướng nhận thêm electron để đạt 8 electron ở lớp ngoài cùng tạo thành ion âm
Lời giải:
- Cấu hình nguyên tử nitrogen (Z = 7): 1s22s22p3
=> Có 5 electron ở lớp vỏ ngoài cùng => Có xu hướng nhận thêm 3 electron để đạt cấu hình electron khí hiếm
- Cấu hình nguyên tử nhôm (Z = 13): 1s22s22p63s23p1
=> Có 3 electron ở lớp vỏ ngoài cùng => Có xu hướng nhường đi 3 electron để đạt cấu hình electron khí hiếm
Đáp án A
Bài 2 trang 52 Hóa học 10: Nguyên tử nguyên tố nào sau đây có xu hướng nhường đi 1 electron khi hình thành liên kết hóa học?
A. Boron
B. Potassium
C. Helium
D. Fluorine
Phương pháp giải:
- Nguyên tố Boron: Z = 5
- Nguyên tố Potassium: Z = 19
- Nguyên tố Helium: Z = 2
- Nguyên tố Fluorine: Z = 9
Bước 1: Viết cấu hình electron các nguyên tố
Bước 2: Từ cấu hình electron ở lớp vỏ ngoài cùng => Nguyên tố có xu hướng nhường đi electron
Lời giải:
- Cấu hình electron B (Z = 5): 1s22s22p1 => Có 3 electron ở lớp ngoài cùng => Xu hướng nhường đi 3 electron
- Cấu hình electron K (Z = 19): 1s22s22p63s23p64s1 => Có 1 electron ở lớp ngoài cùng => Xu hướng nhường đi 1 electron
- Cấu hình electron He (Z = 2): 1s2 => Đạt cấu hình bền vững
- Cấu hình electron F (Z = 9): 1s22s22p5 => Có 7 electron ở lớp ngoài cùng => Xu hướng nhận thêm 1 electron
=> Nguyên tử nguyên tố Potassium (K, Z = 19) có xu hướng nhường đi 1 electron khi hình thành liên kết hóa học
Đáp án B
Bài 3 trang 52 Hóa học 10: Xu hướng tạo lớp vỏ bền vững hơn của các nguyên tử thể hiện như thế nào trong các trường hợp sau đây?
a) Kim loại điển hình tác dụng với phi kim điển hình
b) Phi kim tác dụng với phi kim
Phương pháp giải:
a) Kim loại có xu hướng nhường electron, phi kim có xu hướng nhận electron
b) Hai phi kim đều có xu hướng nhận thêm electron
Lời giải:
a)
- Kim loại có xu hướng nhường electron, phi kim có xu hướng nhận electron
=> Phi kim sẽ lấy electron của kim loại để cả phi kim và kim loại đạt cấu hình electron bền vững của khí hiếm
- Ví dụ: NaCl
+ Na: có 1 electron ở lớp ngoài cùng
+ Cl: có 7 electron ở lớp ngoài cùng
=> Na sẽ nhường 1 electron và Cl sẽ nhận 1 electron của Na để đạt cấu hình có 8 electron ở lớp vỏ ngoài cùng
b)
- Hai phi kim đều có xu hướng nhận thêm electron
=> Cả 2 phi kim sẽ bỏ ra electron để góp chung
Ví dụ: N2 tác dụng với H2 tạo thành NH3
+ N: có 5 electron ở lớp ngoài cùng => Cần nhận thêm 3 electron
+ H: có 1 electron ở lớp ngoài cùng => Cần nhận thêm 1 electron
=> N sẽ bỏ ra 3 electron và 3H mỗi H bỏ ra 1 electron để góp chung
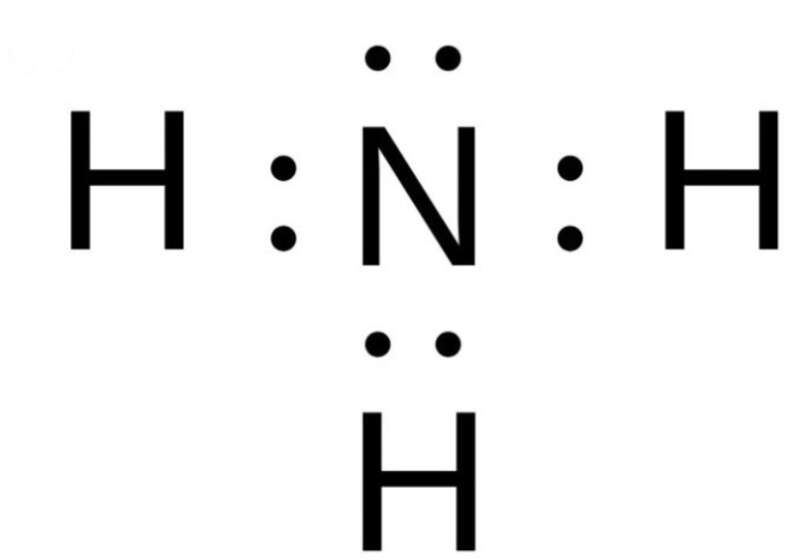
Bài 4 trang 52 Hóa học 10: Ở dạng đơn chất, sodium (Na) và chlorine (Cl) rất dễ tham gia các phản ứng hóa học, nhưng muối ăn được tạo nên từ hai nguyên tố này lại không dễ dàng tham gia các phản ứng mà có sự nhường hoặc nhận electron. Giải thích
Phương pháp giải:
- Na: có 1 electron ở lớp ngoài cùng
- Cl: có 7 electron ở lớp ngoài cùng
- NaCl: 2 nguyên tố liên kết chặt chẽ với nhau
Lời giải:
- Cấu hình electron Na (Z = 11): 1s22s22p63s1 => Có 1 electron ở lớp ngoài cùng
=> Xu hướng cho đi 1 electron để đạt cấu hình electron bền vững
=> Dễ dàng tham gia phản ứng hóa học
- Cấu hình electron của Cl (Z = 17): 1s22s22p63s23p5 => Có 7 electron ở lớp ngoài cùng
=> Xu hướng nhận thêm 1 electron để đạt cấu hình electron bền vững
=> Dễ dàng tham gia phản ứng hóa học
- NaCl: Được tạo bởi 2 nguyên tố là Na và Cl. Trong hợp chất này Na sẽ nhường 1 electron và Cl sẽ nhận 1 electron của Na để đạt cấu hình có 8 electron ở lớp vỏ ngoài cùng
=> Cả 2 nguyên tử đều đạt cấu hình electron bền vững
=> NaCl khó tham gia các phản ứng mà có sự nhường hoặc nhận elecrton
Bài 5 trang 52 Hóa học 10: Cho một số hydrocarbon sau:
a) Những nguyên tử H và C nào trong các hydrocarbon trên thỏa mãn quy tắc octet? Biết rằng mỗi gạch (-) trong các công thức biểu diễn hai electron hóa trị chung
b) Một phân tử hydrocarbon có ba nguyên tử C và x nguyên tử H. Giá trị x lớn nhất có thể là bao nhiêu?
Phương pháp giải:
a) Quy tắc octet: Trong phản ứng hóa học, các nguyên tử có xu hướng hình thành lớp vỏ bền vững như của khí hiếm
b)
- Nguyên tử C có 4 electron ở lớp vỏ ngoài cùng => Khi tham gia liên kết sẽ góp chung 4 electron
- Nguyên tử H có 1 electron ở lớp vỏ ngoài cùng => Khi tham gia liên kết sẽ góp chung 1 electron
Lời giải:
- Nguyên tử C có 4 electron ở lớp vỏ ngoài cùng => Khi tham gia liên kết sẽ góp chung 4 electron
- Nguyên tử H có 1 electron ở lớp vỏ ngoài cùng => Khi tham gia liên kết sẽ góp chung 1 electron
a)
- Xét hydrocarbon:
+ Mỗi nguyên tử C có 4 (-), như vậy xung quanh mỗi nguyên tử C có 4 đôi electron chung => Có 8 electron ở lớp vỏ ngoài cùng => Đạt cấu hình khí hiếm Ne
+ Mỗi nguyên tử H có 1 (-), như vậy xung quanh mỗi nguyên tử H có 1 đôi electron chung => Có 2 electron ở lớp vỏ ngoài cùng => Đạt cấu hình khí hiếm He
=> Thỏa mãn quy tắc octet
- Xét hydrocarbon:
+ Mỗi nguyên tử C có 4 (-) 2 gạch giữa 2 C và 2 gạch với H, như vậy xung quanh mỗi nguyên tử C có 4 đôi electron chung => Có 8 electron ở lớp vỏ ngoài cùng => Đạt cấu hình khí hiếm Ne
+ Mỗi nguyên tử H có 1 (-) giữa C và H, như vậy xung quanh mỗi nguyên tử H có 1 đôi electron chung => Có 2 electron ở lớp vỏ ngoài cùng => Đạt cấu hình khí hiếm He
=> Thỏa mãn quy tắc octet
- Xét hydrocarbon:
+ Mỗi nguyên tử C có 4 (-) 1 gạch giữa 2 C và 3 gạch với H, như vậy xung quanh mỗi nguyên tử C có 4 đôi electron chung => Có 8 electron ở lớp vỏ ngoài cùng => Đạt cấu hình khí hiếm Ne
+ Mỗi nguyên tử H có 1 (-) giữa C và H, như vậy xung quanh mỗi nguyên tử H có 1 đôi electron chung => Có 2 electron ở lớp vỏ ngoài cùng => Đạt cấu hình khí hiếm He
=> Thỏa mãn quy tắc octet
b)
- Nguyên tử C tham gia 4 liên kết, nguyên tử H tham gia 1 liên kết để đạt cấu hình electron bền vững của khí hiếm
- Trong phân tử hydrocarbon, để x lớn nhất thì liên kết giữa C-H phải nhiều nhất
=> Liên kết giữa C và C phải là 1 (-)
Ta được công thức như sau:
=> Có 8 nguyên tử H
=> Giá trị x lớn nhất có thể là 8
Xem thêm các bài giải Hóa học lớp 10 Cánh diều tạo hay, chi tiết khác: