Với Giải hóa học lớp 10 trang 20 Cánh diều chi tiết giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 10. Mời các bạn đón xem:
Giải hóa học 10 trang 20 Cánh diều
Bài 1 trang 20 Hóa học 10: Hoàn thành bảng sau đây:
|
Kí hiệu |
Số hiệu nguyên tử |
Số khối |
Số proton |
Số electron |
Số neutron |
|
|
? |
? |
? |
? |
? |
|
? |
? |
39 |
19 |
? |
? |
|
? |
16 |
? |
? |
? |
20 |
Phương pháp giải:
- Kí kiệu nguyên tử cho biết kí hiệu hóa học của nguyên tố (X), số hiệu nguyên tử (Z) và số khối (A)
- Số hiệu nguyên tử = số proton = số electron
- Số khối = số proton + số neutron
Lời giải:
-
+ Có số hiệu nguyên tử = số proton = số electron = 18
+ Số khối = 40
+ Số neutron = 40 – 18 = 22
- Số khối = 39, số proton = 19 => Nguyên tố Kali (K)
+ Số hiệu nguyên tử = số proton = số electron = 19
+ Số neutron = 39 – 19 = 20
- Số hiệu nguyên tử = 16, số neutron = 20
+ Số hiệu nguyên tử = số proton = số electron = 16 => Nguyên tố lưu huỳnh (S)
+ Số khối = số proton + số neutron = 16 + 20 = 36
Hoàn thành bảng
|
Kí hiệu |
Số hiệu nguyên tử |
Số khối |
Số proton |
Số electron |
Số neutron |
|
|
18 |
40 |
18 |
18 |
22 |
|
|
19 |
39 |
19 |
19 |
20 |
|
|
16 |
36 |
16 |
16 |
20 |
Bài 2 trang 20 Hóa học 10: Những phát biểu nào sau đây là đúng?
(a) Những nguyên tử có cùng số electron thì thuộc cùng một nguyên tố hóa học
(b) Hai ion dương (ion một nguyên tử) có điện tích lần lượt là +2 và +3, đều có 26 proton. Vậy hai ion này thuộc cùng một nguyên tố hóa học
(c) Hai nguyên tử A và B đều có số khối là 14. Vậy hai nguyên tử này thuộc cùng một nguyên tố hóa học.
(d) Những nguyên tử có cùng số neutron thì thuộc cùng một nguyên tố hóa học.
Phương pháp giải:
(a). Những nguyên tử đều có số electron = số proton
(b). Hai ion đều có cùng số proton mà số proton = số hiệu nguyên tử
(c). Nguyên tố hóa học là những nguyên tử có cùng điện tích hạt nhân
(d). Nguyên tố hóa học là những nguyên tử có cùng điện tích hạt nhân
Lời giải:
- Nguyên tố hóa học là những nguyên tử có cùng điện tích hạt nhân
=> Tất cả nguyên tử của cùng 1 nguyên tố hóa học đều có cùng số proton và cùng số electron.
=> (a) đúng
- Hai ion đều có 26 proton hay đều có số hiệu nguyên tử = 26
=> Hai ion dương này đều thuộc cùng 1 nguyên tố hóa học
=> (b) đúng
- Nguyên tố hóa học là những nguyên tử có cùng điện tích hạt nhân
=> (c), (d) sai
Vậy những phát biểu đúng là: (a) và (b)
Bài 3 trang 20 Hóa học 10: Trong tự nhiên, đồng có hai đồng vị bền là 63Cu và 65Cu. Nguyên tử khối trung bình của đồng là 63,54. Tính số mol mỗi loại đồng vị có trong 6,354 gam đồng
Phương pháp giải:
Bước 1: Tính số mol đồng
Bước 2: Gọi tỉ lệ phần trăm của đồng vị 63Cu trong tự nhiên là x
=> Tỉ lệ phần trăm của đồng vị 65Cu trong tự nhiên là 100 – x
Bước 3: Áp dụng công thức: => Tìm ra giá trị của x
Bước 4: Từ phần trăm của mỗi đồng vị => Số mol của mỗi đồng vị
Lời giải:
Ta có: nCu = 6,354 : 63,54 = 0,1 (mol)
Gọi tỉ lệ phần trăm của đồng vị 63Cu trong tự nhiên là x
=> Tỉ lệ phần trăm của đồng vị 65Cu trong tự nhiên là 100 – x
- Nguyên tử khối trung bình của Cu là 63,54
=>
=> x = 73
=> Tỉ lệ phần trăm của đồng vị 63Cu trong tự nhiên là 73%
=> Trong 0,1 mol Cu sẽ có 0,1.73% = 0,073 mol 63Cu
=> Trong 0,1 mol Cu sẽ có 0,1 - 0,073 = 0,022 mol 65Cu
Bài 4 trang 20 Hóa học 10: Phổ khối, hay phổ khối lượng (MS: Mass Spectrum) chủ yếu được sử dụng để xác định phân tử khối, nguyên tử khối của các chất và hàm lượng các đồng vị bền của một nguyên tố. Phổ khối của neon được biểu diễn như ở Hình 3.5.
Trục tung biểu thị hàm lượng phần trăm về số nguyên tử của từng đồng vị, trục hoành biểu thị tỉ số của nguyên tử khối (m) của mỗi đồng vị với điện tích của các ion đồng vị tương ứng (điện tích z của các ion đồng vị neon đều bằng +1).
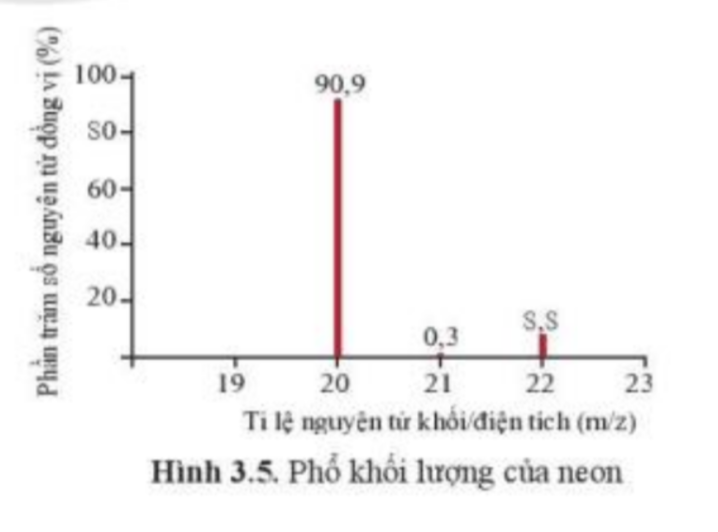
a) Neon có bao nhiêu đồng vị bền?
b) Tính nguyên tử khối trung bình của Neon.
Phương pháp giải:
a) Dựa vào Hình 3.5, nêu các đồng vị bền của Neon
b) Công thức tính nguyên tử khối trung bình:
Lời giải:
a) Neon có 3 đồng vị bền:
+ Đồng vị 20Ne chiếm 90,9%
+ Đồng vị 21Ne chiếm 0,3%
+ Đồng vị 22Ne chiếm 8,8%
b) Công thức tính nguyên tử khối trung bình:
=>
Vậy nguyên tử khối trung bình của Neon là 20,18
Xem thêm các bài giải Hóa học lớp 10 Cánh diều tạo hay, chi tiết khác: