Với Giải hóa học lớp 10 trang 47 Chân trời sáng tạo chi tiết giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 10. Mời các bạn đón xem:
Giải hóa học 10 trang 47 Chân trời sáng tạo
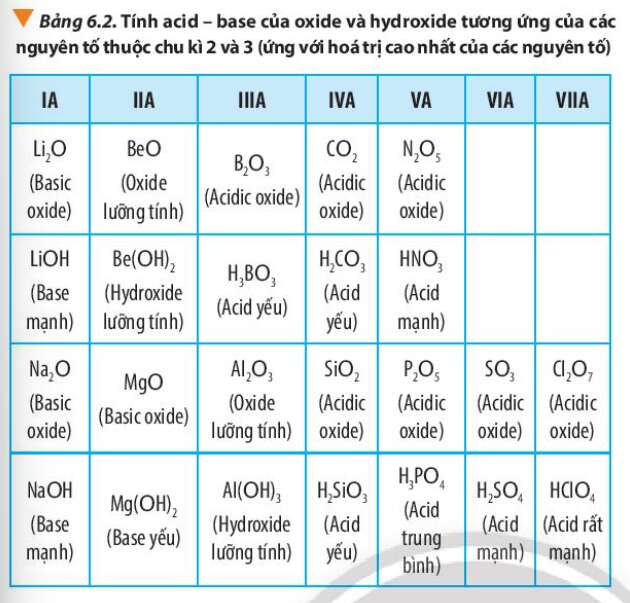
Câu hỏi 8 trang 47 Hóa học 10: Quan sát Bảng 6.2, hãy liên hệ xu hướng biến đổi tính acid, tính base của oxide và hydroxide tương ứng với tính kim loại, phi kim của các nguyên tố trong chu kì
Phương pháp giải:
Quan sát Bảng 6.2 và rút ra nhận xét
Lời giải:
- Trong 1 chu kì:
+ Tính kim loại giảm dần, tính phi kim tăng dần.
+ Tính base của oxide, hydroxide giảm dần; tính acid của oxide, hydroxide tăng dần
Luyện tập trang 47 Hóa học 10: Dựa vào xu hướng biến đổi tính acid - base của oxide và hydroxide tương ứng của các nguyên tố trong bảng tuần hoàn, hãy sắp xếp các hợp chất sau đây theo chiều giảm dần tính acid của chúng: H2SiO3, HClO4, H2SO4, H3PO4
Phương pháp giải:
- Si, Cl, S, P thuộc cùng chu kì 2
- Trong 1 chu kì, tính phi kim tăng dần, tính acid tăng dần
Lời giải:
- Trong cùng 1 chu kì, tính từ trái trang phải, tính acid của hydroxide tương ứng của các nguyên tố trong bảng tuần hoàn tăng dần
=> Sắp xếp theo chiều giảm dần tính acid: HClO4 > H2SO4 > H3PO4 > H2SiO4
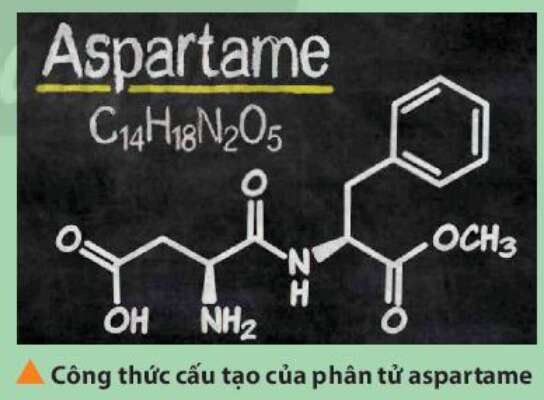
Vận dụng trang 47 Hóa học 10: Aspartame là một chất làm ngọt nhân tạo, được sử dụng trong một số loại soda dành cho người ăn kiêng. Xác định vị trí của các nguyên tố tạo nên aspartame trong bảng tuần hoàn. Trong số các nguyên tố đó, nguyên tố nào có tính phi kim mạnh nhất?
Phương pháp giải:
- Các nguyên tố tạo nên aspartame: C, H, N, O
- Trong cùng 1 chu kì, tính từ trái sang phải, tính phi kim tăng dần
- Trong cùng 1 nhóm, đi từ trên xuống dưới, tính phi kim giảm dần
Lời giải:
- H: ô số 1, nhóm IA, chu kì 1
- C: ô số 6, nhóm IVA, chu kì 2
- N: ô số 7, nhóm VA, chu kì 2
- O: ô số 8, nhóm VIA, chu kì 2
- Trong cùng 1 chu kì, theo chiều tăng dần điện tích hạt nhân, tính phi kim tăng dần
=> Tính phi kim: C < N < O
- H có tính phi kim yếu
=> Nguyên tố O có tính phi kim mạnh nhất
Bài 1 trang 47 Hóa học 10: Nguyên tử của nguyên tố nào sau đây có bán kính nhỏ nhất?
A. Si (Z = 14)
B. P (Z = 15)
C. Ge (Z = 32)
D. As (Z = 33)
Phương pháp giải:
- Dựa vào số hiệu nguyên tử, xác định vị trí của các nguyên tố trong bảng tuần hoàn
- Trong cùng 1 chu kì, đi từ trái sang phải, bán kính giảm dần
- Trong cùng 1 nhóm, đi từ trên xuống dưới, bán kính tăng dần
Lời giải:
- Si: nhóm IVA, chu kì 3
- P: nhóm VA, chu kì 3
- Ge: nhóm IVA, chu kì 4
- As: nhóm VA, chu kì 4
=> Bán kính: Si > P (vì cùng chu kì, Si đứng trước P)
Bán kính: Si < Ge (vì cùng 1 nhóm, Si đứng trên Ge)
Bán kính: Ge > As (vì cùng 1 chu kì, Ge đứng trước As)
Bán kính P < As (vì cùng 1 nhóm, P đứng trên As)
=> P < As, Si < Ge
=> P có bán kính nhỏ nhất
Đáp án B
Xem thêm các bài giải Hóa học lớp 10 Chân trời sáng tạo hay, chi tiết khác: