Tailieumoi.vn giới thiệu Giải sách bài tập Hóa học lớp 11 Bài 13: Luyện tập: Tính chất của Nitơ, photpho và các hợp chất của chúng chi tiết giúp học sinh xem và so sánh lời giải từ đó biết cách làm bài tập trong SBT Hóa học 11. Mời các bạn đón xem:
Giải SBT Hóa học 11 Bài 13: Luyện tập: Tính chất của Nitơ, photpho và các hợp chất của chúng
Bài 13.1 trang 20 SBT Hóa học 11: Khí nitơ có thể được tạo thành trong các phản ứng hoá học nào sau đây ?
A. Đốt cháy NH3 trong oxi có mặt chất xúc tác platin
B. Nhiệt phân NH4NO3
C. Nhiệt phân AgNO3
D. Nhiệt phân NH4NO2
Phương pháp giải:
Xem lại lí thuyết về nitơ và hợp chất của nitơ
Lời giải:
=> Chọn D
Bài 13.2 trang 20 SBT Hóa học 11: Cặp chất nào sau đây có thể tồn tại trong cùng một dung dịch ?
A. Axit nitric và đồng(II) nitrat
B. Đồng(II) nitrat và amoniac
C. Bari hiđroxit và axit photphoric.
D. Amoni hiđrophotphat và kali hiđroxit
Phương pháp giải:
Chất cùng tồn tại trong một dung dịch là chất không phản ứng với nhau.
Lời giải:
Trong các cặp chất trên axit nitric và đồng(II) nitrat không phản ứng với nhau.
=> Chọn A
Bài 13.3 trang 20 SBT Hóa học 11: Trong các phản ứng dưới đây của amoniac, phản ứng nào không phải là phản ứng oxi hóa – khử?
A. 4NH3 + 3O2 → 2N2 + 6H2O
B. 4NH3 + 5O2 → 4NO + 6H2O
C. 4NH3 + Cu(OH)2 → [Cu(NH3)2](OH)2
D. 2NH3 + 3Cl2→N2 +6HCl
Phương pháp giải:
Phản ứng oxi hóa – khử là phản ứng trong đó có sự thay đổi số oxi hóa của một số chất.
Lời giải :
Trong các phản ứng trên phản ứng 4NH3 + Cu(OH)2 → [Cu(NH3)2](OH)2 có các chất trước và sau phản ứng không thay đổi số oxi hóa
=> Chọn C
Bài 13.4 trang 20 SBT Hóa học 11: Hoà tan 12,8 g kim loại hoá trị II trong một lượng vừa đủ dung dịch 60% (D = 1,365 g/ml), thu được 8,96 lít (đktc) một khí duy nhất màu nâu đỏ. Tên của kim loại và thể tích dung dịch đã phản ứng là
A. đồng ; 61,5 ml.
B. chì ; 65,1 ml.
C. thuỷ ngân ; 125,6 ml.
D. sắt; 82,3 ml.
Phương pháp giải:
+) PTHH:
+) Tính số mol khí => = 0,2 mol và
+) Áp dụng CT: m=M.n => M => Xác định kim loại
+) Áp dụng CT:
=> VHCl
Lời giải:
(màu nâu đỏ)
Số mol khí : = 0,4 (mol).
Theo phương trình hoá học :
= 0,2 mol và = 0,8 (mol).
Khối lượng mol nguyên tử của kim loại M :
M =
kim loại là Cu (đồng).
Gọi V (ml) là thể tích của dung dịch HNO3 60%. Ta có phương trình liên hệ V với :
=> Chọn A
Bài 13.5 trang 20 SBT Hóa học 11: Viết các phương trình hóa học thực hiện các dãy chuyển hóa sau:
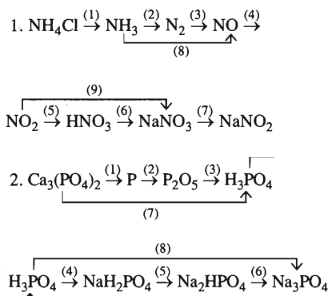
Lời giải:
1. (1)
(2)
(3)
(4)
(5)
(6)
(7)
(8)
(9)
2. (1)
(2)
(3)
(4)
(5)
(6)
(7)
(8)
Bài 13.6 trang 21 SBT Hóa học 11: Viết phương trình hoá học ở dạng phân tử và dạng ion rút gọn của phản ứng xảy ra trong dung dịch giữa các chất sau :
1. Bari clorua và natri photphat.
2. Axit photphoric và canxi hiđroxit, tạo ra muối axit ít tan.
3. Axit nitric đặc, nóng và sắt kim loại.
4. Natri nitrat, axit sunfuric loãng và đồng kim loại.
Lời giải:
Phương trình hoá học ở dạng phân tử và dạng ion rút gọn của các phản ứng xảy ra trong dung dịch :
1. 3BaCl2 + 2Na3PO4 6NaCl + Ba3(PO4)2
3Ba2+ + 2 Ba3(PO4)2
2. + Ca(OH)2 CaHPO4 + 2H2O
+ Ca2+ + 2 CaHPO4 + 2H2O
3. 6(đặc) + Fe Fe(NO3)3 + 3NO2 + 3H2O
6H+ + 3 + Fe Fe3+ + 3NO2 + 3H2O
4. 3Cu + 4H2SO4(loãng) + 8NaNO3 3Cu(NO3)2 + 2NO + 4Na2SO4 + 4H2O
3Cu + 8H+ + 2 3Cu2+ + 2NO + 4H2O
Bài 13.7 trang 21 SBT Hóa học 11: Có 4 lọ không dán nhãn đựng riêng biệt từng dung dịch loãng của các chất sau : H3PO4, BaCl2, Na2CO3, (NH4)2SO4. Chỉ được sử dụng dung dịch HCl, hãy nêu cách nhận biết chất đựng trong mỗi lọ. Viết phương trình hoá học của các phản ứng.
Phương pháp giải:
+) Dùng HCl nhận ra Na2CO3
+) Dùng Na2CO3 nhận ra H3PO4 và BaCl2
+) Còn lại (NH4)2SO4
Lời giải:
- Lấy một phần mỗi dung dịch vào từng ống nghiệm, rồi nhỏ dung dịch HCl vào. Ở ống nghiệm có khí thoát ra là ống đựng dung dịch Na2CO3.
Na2CO3 + 2HCl 2NaCl + CO2 + H2O
- Phân biệt dung dịch H3PO4, BaCl2 và (NH4)2SO4 bằng cách cho Na2CO3 tác dụng với từng dung dịch : dung dịch nào khi phản ứng cho khí thoát ra là H3PO4, dung dịch nào khi phản ứng có kết tủa trắng xuất hiện là BaCl2, dung dịch nào khi phản ứng không có hiện tượng gì là (NH4)2SO4 :
2H3PO4 + 3Na2CO3 2Na3PO4 + 3CO2 + 3H2O
BaCl2 +Na2CO3 BaCO3 + 2NaCl
Bài 13.8 trang 21 SBT Hóa học 11: Cho các chất sau : 3Ca3(PO4)2.CaF2, H3PO4, NH4H2PO4, NaH2PO4, K3PO4, Ag3PO4. Hãy lập một dãy chuyển hoá biểu diễn mối quan hệ giữa các chất đó. Viết phương trình hoá học của các phản ứng thực hiện dãy chuyển hoá trên.
Phương pháp giải:
Gợi ý:
3Ca3(PO4)2.CaF2 H3PO4 NH4H2PO4 NaH2PO4 K3PO4 Ag3PO4
Lời giải:
Dãy chuyển hoá biểu diễn mối quan hệ giữa các chất có thể là :
3Ca3(PO4)2.CaF2 H3PO4 NH4H2PO4 NaH2PO4 K3PO4 Ag3PO4
Các phương trình hoá học :
(1) 3Ca3(PO4)2.CaF2 + 10H2SO4(đặc) 6H3PO4 + 10CaS04 + 2HF
(2) H3PO4 + NH3 NH4H2PO4
(3) NH4H2PO4 + NaOH NaH2P04 + NH3 +
(4) 3NaH2PO4 + 6KOH Na3PO4 + 2K3PO4 + 6
(5) K3PO4 + 3AgNO3
Bài 13.9 trang 21 SBT Hóa học 11: Rót dung dịch chứa 11,76 g H3PO4 vào dung dịch chứa 16,8 g KOH. Sau phản ứng, cho dung dịch bay hơi đến khô. Tính khối lượng muối khan thu được.
Phương pháp giải:
+) Tính số mol và số mol KOH
+) Xét tỉ lệ T= => Công thức của muối tạo thành sau phản ứng.
+) Gọi x là số mol tham gia phản ứng (2) và y là số mol tham gia phản ứng (3). Lập hpt => x, y => Khối lượng hai muối
Lời giải:
Số mol : = 0,12 (mol)
Số mol KOH : = 0,3 (mol)
Các phản ứng có thể xảy ra :
Vì tỉ lệ = 0,3 : 0,12 = 2,5 nằm giữa 2 và 3, nên chỉ xảy ra các phản ứng (2) và (3), nghĩa là tạo ra hai muối K2HPO4 và K3PO4.
Gọi x là số mol tham gia phản ứng (2) và y là số mol tham gia phản ứng (3) :
x + y = 0,12 (a)
Theo các phản ứng (2) và (3) tổng số mol KOH tham gia phản ứng :
2x + 3y = 0,3 (b)
Giải hệ phương trình (a) và (b) : x = 0,06 mol K2HPO4 ; y = 0,06 mol K3PO4.
Tổng khối lượng hai muối:
= 0,06.174 + 0,06.212 = 10,44 + 12,72 = 23,16 (g).