Tailieumoi.vn giới thiệu Giải bài tập Hóa học lớp 11 Bài 46: Luyện tập: Anđehit - Xeton - Axit cacboxylic chính xác, chi tiết nhất giúp học sinh dễ dàng làm bài tập Luyện tập: Anđehit - Xeton - Axit cacboxylic lớp 11.
Giải bài tập Hóa học lớp 11 Bài 46: Luyện tập: Anđehit - Xeton - Axit cacboxylic
Câu hỏi và bài tập( trang 212, 213 SGK Hóa học 11)
Bài 1 trang 212 SGK Hóa học 11: Điền Đ (đúng) hoặc S ( sai) vào ô vuông bên cạnh các câu sau:
a) Anđehit vừa có tính khử vừa có tính oxi hóa.
b) Anđehit là hợp chất lưỡng tính.
c) Khi tác dụng với hiđro có xúc tác Ni, anđehit chuyển thành ancol bậc I
d) Axit axetic tác dụng được với dung dịch bazơ, oxit bazơ, muối cacbonat và kim loại đứng trước hiđro trong dãy hoạt động hóa học của kim loại.
e) Oxi hóa không hoàn toàn ancol bậc II thu được xeton.
g) Trong công nghiệp, axeton được tổng hợp từ cumen.
Lời giải :
a - Đ e - Đ
b - S g - Đ
c - Đ
d - Đ
Bài 2 trang 212 SGK Hóa học 11: Trình bày phương pháp hóa học để phân biệt các dung dịch: anđehit axetic, axit axetic, glixerol, ancol etylic.
Lời giải :
- Cho quỳ tím lần lượt vào các dung dịch trên:
+ Qùy tím chuyển dần sang màu đỏ là: CH3COOH
+ Còn lại các dung dịch không làm quỳ tím chuyển màu là: CH3CHO; C3H5(OH)3; C2H5OH
- Cho Cu(OH)2 trong môi trường NaOH vào các chất còn lại, tạo thành dung dịch màu xanh thẫm là C3H5(OH)3. Đun nóng tạo ra kết tủa đỏ gạch là CH3CHO, còn lại không có hiện tượng gì là C2H5OH
2C3H5(OH)3 + Cu(OH)2 → [C3H5(OH)2O]2Cu + H2O
CH3CHO + 2Cu(OH)2 + NaOH CH3COONa + Cu2O↓ + 3H2O
Bài 3 trang 212 SGK Hóa học 11: Dẫn hỗn hợp khí X gồm axetilen và anđehit axetic vào dung dịch AgNO3 trong ammoniac thấy tạo ra kết tủa gồm hai chất. lấy kết tủa cho vào dung dịch axit HCl dư thấy có khí bay lên và còn một phần không tan Y. Hòa tan Y trong dung dịch HNO3 đặc thấy có khí màu nâu bay lên. Viết phương trình hóa học của các phản ứng xảy ra để giải thích quá trình thí nghiệm trên.
Lời giải:
C2H2 + 2AgNO3 + 2NH3 → C2Ag2 ↓ + 2NH4NO3
CH3CHO + 2AgNO3 + 3NH3 + H2O → CH3COONH4 + 2Ag ↓ + 2NH4NO3
Lọc kết tủa: C2Ag2 và Ag cho vào HCl chỉ có C2Ag2 phản ứng:
C2Ag2 + 2HCl → 2AgCl ↓ + C2H2 ↑
Phần không tan Y là AgCl và Ag, hòa tan trong HNO3 đặc chỉ có Ag phản ứng
Ag + 2HNO3 → AgNO3 + NO2 ↑ (màu nâu) + H2O
AgCl không tan trong HNO3
Bài 4 trang 213 SGK Hóa học 11: Cho 1 gam axit axetic vào ống nghiệm thứ nhất và 1 gam axit fomic vào ống nghiệm thứ hai, sau đó cho vào cả hai ống nghiệm trên một lượng dư bột CaCO3. Đến khi phản ứng xảy ra hoàn toàn thì thể tích khí CO2 thu được (đo ở dùng điều kiện) thoát ra.
A. Từ hai ống nghiệm là bằng nhau.
B. Từ ống nghiệm thứ nhất nhiều hơn ống nghiệm thứ hai
C. Từ ống nghiệm thứ hai nhiều hơn ống nghiệm thứ nhất.
D. Từ mỗi ống nghiệm đều lớn hơn 2,24 lít (đktc).
Phương pháp giải:
Cùng khối lượng như nhau, chất nào có phân tử khối nhỏ hơn, sẽ cho lượng khí CO2 thoát ra nhiều hơn
Lời giải:
(1)
(2)
Ta có:
Theo phương trình (1):
Ta có:
Theo phương trình (2):
Vậy số mol CO2 thoát ra từ ống nghiệm hai nhiều hơn ống nghiệm thứ nhất.
Bài 5 trang 213 SGK Hóa học 11: Hỗn hợp A có khối lượng 10,0 gam gồm axit axetic và anđehit axetic. Cho A tác dụng với lượng dư AgNO3 trong dung dịch ammoniac thấy có 21,6 gam Ag kết tủa. Để trung hòa A cần V ml dung dịch NaOH 0,2M
a) Viết phương trình hóa học của các phản ứng xảy ra.
b) Tính thành phần phần trăm khối lượng của mỗi chất trong A và tính thể tích dung tích NaOH đã dùng.
Phương pháp giải :
Chỉ có andehit axetic mới tác dụng được với dd AgNO3 trong dung dịch ammoniac.
Phản ứng trung hòa là phản ứng giữa axit và bazo
a) PTHH: CH3CHO + 2AgNO3 + 3NH3 → CH3COONH4 +2Ag↓ + 2NH4NO3
CH3COOH + NaOH → CH3COONa + H2O
b)
nCH3CHO = ½ nAg = ? (mol)
Có 10 gam hỗn hợp => mCH3COOH = 10 – mCH3CHO =? (g)
=> nCH3COOH =?
=> nNaOH = nCH3COOH = ?
=> VNaOH = n : CM
Lời giải :
a) PTHH:
CH3CHO + 2AgNO3 + 3NH3 → CH3COONH4 +2Ag↓ + 2NH4NO3 (1)
CH3COOH + NaOH → CH3COONa + H2O (2)
b)
Bài 6 trang 213 SGK Hóa học 11: Viết phương trình hóa học của các phản ứng hoàn thành dãy chuyển hóa sau:
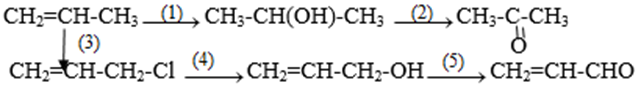
Phương pháp giải :
Các điều kiện phản ứng
(1) Cộng H2O/xt H+ ; (2) oxi hóa, ví dụ bằng CuO ; (3) tác dụng với clo, ở 4500C ; (4) thủy phân trong môi trường bazơ ; (5) oxi hóa, ví dụ bằng CuO.
Lời giải :
(1)
(2)
(3)
(4)
(5)
Bài 7 trang 213 SGK Hóa học 11: Hợp chất X có công thức phân tử C3H6O tác dụng với một lượng dư AgNO3 trong dung dịch NH3. Công thức nào sau đây là công thức cấu tạo của X.
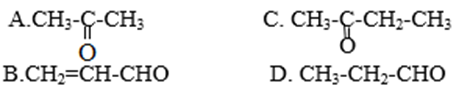
Lời giải :
X tác dụng được với AgNO3 trong dung dịch NH3 => X là anđehit
CTCT của X có CTPT C3H6O là CH3CH2CH=O
Đáp án D
Bài 8 trang 213 SGK Hóa học 11: Cho dung dịch chứa 0,58 gam chất hữu cơ X tác dụng với một lượng dư AgNO3 trong dung dịch NH3 thu được 2,15 gam kết tủa.
Xác định công thức phân tử, viết công thức cấu tạo và gọi tên của hợp chất X
Phương pháp giải:
Tính số mol Ag
Hợp chất X đơn chức, tác dụng được với AgNO3 trong dung dịch NH3 => X là anđehit đơn chức
Gọi CTPT của X là RCHO
Từ mol Ag => số mol của X = 1/2 nAg
=> Mx= m: nX = ?
=> CTPT của X từ đó tìm được CTCT
Lời giải :
X là anđehit đơn chức
Gọi CTPT của X là RCHO
RCHO + 2AgNO3 + 3NH3 + H2O → RCOONH4 + 2Ag + 2NH4NO3
nAg = 0.02 mol => nRCHO = nAg = 0,01 mol
MRCHO = 0,58: 0,01 = 58,0 g/mol.
=> R + 29 = 58
=> R = 29( C2H5 )
=> X là CH3CH2CHO : propanal
Bài 9 trang 213 SGK Hóa học 11: Axit fomic tác dụng với AgNO3 trong dung dịch NH3 tạo ra kết tủa bạc kim loại. Dựa vào cấu tạo phân tử của axit fomic để giải thích, viết phương trình hóa học của phản ứng.
Phương pháp giải :
Giải thích cấu tạo của axit focmic giống với anđehit là có nhóm -CHO
Lời giải :
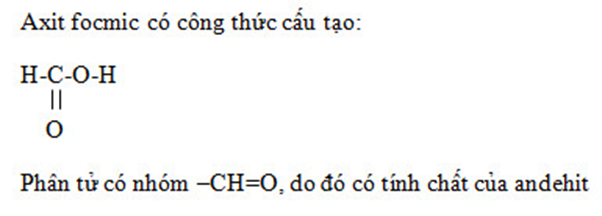
Bài 10 trang 213 SGK Hóa học 11: Dẫn hơi của 3 gam etanol vào trong ống sứ nung nóng chứa bột CuO dư. Làm lạnh để ngưng tụ sản phẩm hơi đi ra khỏi ống sứ được chất lỏng A. Khi A phản ứng hoàn toàn với một lượng dư dung dịch AgNO3 trong NH3 thấy có 8,1 gam bạc kết tủa.
Tính hiệu suất của quá trình oxi hóa etanol?
Lời giải:
C2H5OH + CuO CH3CHO + Cu + H2O
CH3CHO + 2AgNO3 + 3NH3 + H2O → CH3COONH4 + 2Ag + 2NH4NO3
nCH3CHO = nAg = . = 0,0375 mol.
nC2H5OH pư= nCH3CHO = 0,0375 (mol)
=> mC2H5OH pư= 0,0375.46 = 1,725 (g)
Hiệu suất của phản ứng oxi hóa etanol :
- Hệ thống hóa kiến thức về đồng phân, danh pháp và tính chất của anđehit, axit cacboxylic.
- Viết công thức cấu tạo, gọi tên các anđehit, xeton, axit cacboxylic.
- Viết phương trình hóa học của các phản ứng minh họa tính chất hóa học của anđehit, xeton, axit cacboxylic.
- Vận dụng linh hoạt kiến thức về tính chất để giải các bài tập phân biệt các chất và bài toán hóa học.
- Giải các bài tập liên quan đến Anđehit – Xeton – Axit cacboxylic