Tailieumoi.vn giới thiệu Giải sách bài tập Hóa học lớp 9 Bài 32: Luyện tập chương 3 - Phi kim. Sơ lược về bảng tuần hoàn các nguyên tố hóa học chi tiết giúp học sinh xem và so sánh lời giải từ đó biết cách làm bài tập trong SBT Hóa học 9. Mời các bạn đón xem:
Giải SBT Hóa học 9 Bài 32: Luyện tập chương 3 - Phi kim. Sơ lược về bảng tuần hoàn các nguyên tố hóa học
Bài 32.1 trang 40 SBT Hóa học 9: Ngâm hỗn hợp các kim loại Al, Cu, Fe trong mỗi dung dịch sau :
a) Dung dịch CuSO4 (dư).
b) Dung dịch AgNO3 (dư).
c) Dung dịch FeSO4 (dư).
Viết các phương trình hoá học. Kim loại nào thu được trong mỗi trường hợp ?
Phương pháp giải:
Xem lại tính chất hóa học của kim loại và dãy hoạt động hóa học của kim loại.
Lời giải:
- Kim loại Cu thu được sau khi ngâm hỗn hợp các kim loại Al, Cu, Fe vào dung dịch CuSO4 dư
2Al + 3CuSO4 --------> Al2(SO4)3 + 3Cu
Fe + CuSO4 ------- > FeSO4 + Cu
- Kim loại Ag thu được sau khi ngâm hỗn hợp các kim loại AI, Cu, Fe vào dung dịch AgN03 dư :
Al + 3AgNO3 —----> Al(NO3)3 + 3Ag
Fe + 2AgNO3 -------> Fe(NO3)2 + 2Ag
Cu + 2AgNO3 —-----> Cu(NO3)2 + 2Ag
- Kim loại Fe và Cu thu được sau khi ngâm hỗn hợp các kim loại AI, Cu, Fe vào dung dịch FeS04 dư :
2Al + 3FeSO4 -------> Al2(SO4)3 + 3Fe
Bài 32.2 trang 40 SBT Hóa học 9: Khi cho khí clo tác dụng với kim loại, em có nhận xét gì về mức độ hoạt động hoá học của nguyên tố clo. Cho thí dụ minh hoạ.
Lời giải:
Khí clo phản ứng trực tiếp với hầu hết các kim loại, phản ứng xảy ra nhanh và toả nhiệt.
Thí dụ : - Natri kim loại nóng chảy cháy trong khí clo với ngọn lửa sáng chói và ở thành bình xuất hiện lớp natri clorua màu trắng.
- Đồng, sắt, thiếc và nhiều kim loại khác cháy trong clo cho muối clorua tương ứng.
Bài 32.3 trang 40 SBT Hóa học 9: Có bốn mẫu khí A, B, C, D đựng riêng biệt trong các bình thủy tinh. Mỗi khí có một số tính chất trong các tính chất sau:
A. Cháy trong không khí tạo ra chất lỏng không màu (ở nhiệt độ thường), chất lỏng này làm cho đồng(II) sunfat khan màu trắng chuyển thành màu xanh.
B. Độc, cháy với ngọn lửa màu xanh, sinh ra chất khí làm đục nước vôi trong.
C Không cháy nhưng làm cho ngọn lửa cháy sáng chói hơn.
D. Không cháy mà còn làm tắt ngọn lửa và làm quỳ tím ẩm hoá đỏ.
Khí nào nói trên là : hiđro ; oxi ; cacbon đioxit; cacbon oxit ?
Phương pháp giải:
Xem lại tính chất của một số hợp chất vô cơ cho ở trên.
Lời giải:
A : Khí H2 ; C : Khí O2 ;
B : Khí CO ; D : Khí CO2.
Bài 32.4 trang 40 SBT Hóa học 9: Cặp nguyên tố nào sau đây dễ kết hợp với nhau để tạo thành một hợp chất ổn định ?
a)Zn, Ne ; b) H, S ; c) Br, Be ;
d) O, Na ; e) K, Kr.
Phương pháp giải:
Xem lại tính chất hóa học của các đơn chất.
Lời giải:
Những cặp nguyên tố dễ kết hợp với nhau để tạo thành hợp chất ổn định :
b) H, S cho hợp chất H2S ;
c) Br, Be cho hợp chất BeBr2 ;
d) O, Na cho hợp chất Na2O
H2 + S → H2S
Be + Br2 → BeBr2
4Na + O2 → 2Na2O
Bài 32.5 trang 41 SBT Hóa học 9: Có 4 lá kim loại: sắt, đồng, nhôm, bạc. Làm thế nào để có thể nhận biết được mỗi kim loại bằng phương pháp hoá học. Viết các phương trình hoá học.
Phương pháp giải:
Xem lại tính chất hóa học khác nhau giữa các kim loại trên.
Lời giải:
- Kim loại nào tan trong dung dịch NaOH đặc tạo bọt khí bay ra là Al.
- Ba kim loại còn lại, kim loại nào tan trong dung dịch HCl và tạo bọt khí bay lên là Fe.
- Hai kim loại còn lại, kim loại nào đẩy được bạc ra khỏi dung dịch AgNO3 là Cu.
- Kim loại còn lại là Ag (không phản ứng với dung dịch AgNO3).
Bài 32.6 trang 41 SBT Hóa học 9: Trong phòng thí nghiệm có 3 lọ mất nhãn đựng ba chất bột trắng là : BaCO3, NaCl, Na2CO3. Làm thế nào để nhận ra hoá chất trong mỗi lọ với điều kiện chỉ dùng thêm dung dịch HCl loãng ?
Phương pháp giải:
Dựa vào một số hiện tượng đặc trưng để nhận biết các chất.
Lời giải:
- Lần lượt cho 3 chất vào 3 ống nghiệm đựng dung dịch HCl, nếu chất nào tan và có khí bay ra là Na2CO3, BaCO3 và chất nào tan mà không có khí bay ra là NaCl.
- Sau đó hoà tan một ít Na2CO3 và BaCO3 vào nước. Chất nào tan trong nước là Na2CO3
Chất không tan trong nước là BaCO3.
Bài 32.7 trang 41 SBT Hóa học 9: Hình vẽ 3.5 là thiết bị điều chế khí clo trong phòng thí nghiệm.
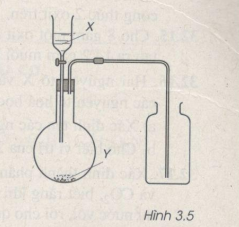
a) X và Y là những chất nào trong số các chất sau ?
X : H2O, dd HCl, dd H2SO4, dd NaOH, dd NaCl.
Y : NaCl, CaCO3, MnO2, CuCl2, Na2S04, KMn04.
Viết phương trình hoá học điều chế khí clo từ những chất đã chọn ở trên.
Lời giải:
a) X là : dd HCl
Y là : MnO2, KMnO4
b) Phương trình hoá học của phản ứng điều chế clo.
Bài 32.8 trang 41 SBT Hóa học 9: Một nguyên tố X tạo được các hợp chất sau : XH3, X2O5. Trong bảng tuần hoàn các nguyên tố hoá học, nguyên tố X cùng nhóm với
A. agon ; B. nitơ ;
C. oxi ; D. flo.
Lời giải:
Vì X tạo được các hợp chất XH3, X2O5 nên X thuộc nhóm VA của bảng tuần hoàn, cùng nhóm với nguyên tố nitơ
Đáp án B.
Bài 32.9 trang 41 SBT Hóa học 9: Cho kim loại Al có dư vào 400 ml dung dịch HCl 1M. Dẫn khí tạo ra qua ống đựng CuO dư, nung nóng thì thu được 11,52 gam Cu. Tính hiệu suất của quá trình phản ứng.
Phương pháp giải:
Viết và tính toán theo phương trình hóa học.
Lời giải:
Theo (1) và (2) ta có sơ đồ chuyển hóa:
6 mol HCl ---> 3 mol ---> 3 mol Cu
0,4 mol HCl x mol Cu
Bài 32.10 trang 41 SBT Hóa học 9: Nung hỗn hợp CaCO3 và MgCO3 thu được 76 gam hai oxit và 33,6 lít CO2 (đktc). Tính khối lượng của hỗn hợp ban đầu.
Phương pháp giải:
Áp dụng định luật bảo toàn khối lượng: mhh = moxit + mkhí
Lời giải:
Phương trình hóa học:
Theo định luật bảo toàn khối lượng:
Lưu ý: trong một phản ứng, có n chất ( kể cả cất tham gia và chất tạo thành), nếu biết n-1 chất thì nên áp dụng định luật bảo toàn khối lượng.
Bài 32.11 trang 41 SBT Hóa học 9: Có hai lá kẽm khối lượng như nhau. Một lá cho vào dung dịch đồng(II) nitrat, lá kia cho vào dung dịch chì(II) nitrat. Sau cùng một thời gian phản ứng, khối lượng lá kẽm thứ nhất giảm 0,05 gam.
a) Viết các phương trình hoá học.
b) Khối lượng lá kẽm thứ 2 tăng hay giảm là bao nhiêu gam ? Biết rằng trong cả 2 phản ứng trên, khối lượng kẽm bị hoà tan bằng nhau.
Phương pháp giải:
Zn + Pb(NO3)2 → Zn(NO3)2 + Pb
Tính toán theo phương trình hóa học. Áp dụng phương pháp tăng-giảm khối lượng.
Lời giải:
x mol x mol
Theo đầu bài ta có : 65x - 64x = 0,05
=> x = 0,05 (mol) ;
mZn = 0,05 x 65 = 3,25 (gam).
Zn + Pb(NO3)2 → Zn(NO3)2 + Pb
0,05 mol 0,05 mol
Khối lượng lá kẽm thứ 2 tăng:
( 0,05 x 207) - 3,25 = 7,1 (gam).
Bài 32.12 trang 41 SBT Hóa học 9: Cho hỗn hợp 2 kim loại Fe và Cu tác dụng với khí clo dư thu được 59,5 gam hỗn hợp muối. Cũng lượng hỗn hợp trên cho tác dụng với lượng dư dung dịch HCl 10% thu được 25,4 gam một muối.
a) Tính phần trăm khối lượng mỗi muối trong hỗn hợp muối thu được.
b) Tính thể tích dung dịch HCl 10% (D = 1,0 g/ml) cần dùng.
Phương pháp giải:
Viết PTHH, lập hệ phương trình 2 ẩn là số mol của hai kim loại.
Lời giải:
x mol x mol
y mol y mol
x mol 2x mol x mol
Theo đề bài và phương trình hóa học trên ta có:
127x = 25,4 => x = 0,2 mol
162,5x + 135y = 59,5. Thay x= 0,2 vào phương trình, ta có:
32,5 + 135y = 59,5 => y = 0,2
b)
maxit cần =0,2 x 2 x 36,5 = 14,6(gam)
mdung dịch HCl =146(gam) =>
Bài 32.13 trang 41 SBT Hóa học 9: Cho 23,6 gam hỗn hợp gồm Mg, Fe, Cu tác dụng vừa hết với 91,25 gam dung dịch HCl 20% thu được dung dịch A và 12,8 gam chất không tan.
Tính khối lượng các kim loại trong hỗn hợp ban đầu.
Phương pháp giải:
Tính toán theo phương trình hóa học. Cu không tác dụng với dung dịch HCl.
Lời giải:
Cu không tác dụng với dung dịch HCl nên 12,8 gam là khối lượng của Cu.
Phương trình hóa học:
x mol 2x mol
y mol 2y mol
Ta có các phương trình:
24x + 56y = 23,6 - 12,8 = 10,8 (I)
2x + 2y = 0,5 (II)
Giải phương trình (I), (II) ta tìm được x và y:
Bài 32.14 trang 42 SBT Hóa học 9: Nguyên tố A tạo được 2 loại oxit. Phần trăm về khối lượng của oxi trong 2 oxit lần lượt bằng 50% và 60%. Xác định nguyên tử khối của A và cho biết công thức 2 oxit trên.
Phương pháp giải:
Đặt công thức tổng quát của hai oxit là: A2Ox và A2Oy. Biện luận để tìm x và y dựa vào % khối lượng
Lời giải:
Gọi công thức 2 oxit là A2Ox và A2Oy, đồng thời kí hiệu A là nguyên tử khối. Ta có tỉ lệ khối lượng oxi trong 2 oxit là : 50% và 60%. Vậy tỉ lệ khối lượng A trong 2 oxit là 50% và 40%.
Chỉ có các cặp x, y sau có thể chấp nhận :
- Nếu chọn x = 2 —> ta có 32 = 2A —> A = 16 (loại) vì A = 16 là oxi.
- Nếu chọn x = 4 —> ta có 64 = 2A —> A = 32 —> A là lưu huỳnh (S).
Tỉ lệ giữa các nguyên tố là tối giản, ta có hai oxit là : SO2 và SO3
Bài 32.15 trang 42 SBT Hóa học 9: Cho 8 gam một oxit (có công thức XO3) tác dụng với dung dịch NaOH dư tạo ra 14,2 gam muối khan. Tính nguyên tử khối của X.
Phương pháp giải:
Phương trình hoá học :
XO3 + 2NaOH -------> Na2XO4 + H2O
(X + 48) gam (46 + X + 64) gam
8 gam 14,2 gam
X kết luận X
Lời giải:
Gọi nguyên tử khối của nguyên tố X cũng là X.
Phương trình hoá học :
XO3 + 2NaOH -------> Na2XO4 + H2O
(X + 48) gam (46 + X + 64) gam
8 gam 14,2 gam
8(46 +X + 64)= 14,2(X + 48)
Giải ra ta có X = 32. Nguyên tố X là lưu huỳnh (S).
Bài 32.16 trang 42 SBT Hóa học 9: Hai nguyên tố X và Y ở hai chu kì kế tiếp nhau trong bảng tuần hoàn các nguyên tố hoá học và có tổng số điện tích hạt nhân là 16.
a) Xác định tên các nguyên tố X và Y
b) Cho biết vị trí của 2 nguyên tố trong bảng tuần hoàn.
Phương pháp giải:
Xem lại bảng tuần hoàn các nguyên tố hóa học và đặc điểm của hai nguyên tố thuộc 2 chu kì liên tiếp trong bảng tuần hoàn.
Lời giải:
a)
Tên nguyên tố X là magie, nguyên tố Y là beri.
b) Nguyên tố Mg ở chu kì 3 nhóm IIA.
Nguyên tố Be ở chu kì 2 nhóm IIA.
Bài 32.17 trang 42 SBT Hóa học 9: Xác định thành phần phần trăm (về thể tích) của hỗn hợp khí gồm N2, CO và CO2, biết rằng khi cho 10,0 lít (ở đktc) hỗn hợp khí đó đi qua một lượng dư nước vôi, rồi cho qua đồng(II) oxit dư đốt nóng thì thu được 5 gam kết tủa và 3,2 gam đồng.
Nếu cũng lấy 10,0 lít (ở đktc) hỗn hợp khí đó cho đi qua ống đồng(II) oxit dư đốt nóng, rồi đi qua một lượng dư nước vôi trong thì thu được bao nhiêu gam kết tủa ?
Phương pháp giải:
a. Theo phương trình phản ứng:
b.
Lời giải:
Phương trình hóa học của phản ứng:
(1)
0,05 mol
(2)
0,05 mol 0,05 mol
Như vậy:
Nếu cho phản ứng (2) thực hiện trước rồi mới đến phản ứng (1) thì
Vậy
Bài 32.18 trang 42 SBT Hóa học 9: Hoà tan 10 gam hỗn hợp 2 muối cacbonat của kim loại hoá trị II và III bằng dung dịch HCl, ta thu được dung dịch X và 0,672 lít khí bay ra (ở đktc). Tính khối lượng muối thu được khi cô cạn dung dịch X.
Phương pháp giải:
Nhận xét quan hệ số mol CO2 và H2O, áp dụng định luật bảo toàn khối lượng hoặc tăng - giảm khối lượng.
Lời giải:
XCO3 + 2HCl XCl2 + CO2 + H2O
Y2(CO3)3 + 6HCl 2YCl3 + 3CO2 + 3H2O
Cách 1 : Viết phương trình hoá học của XCO3 và Y2(CO3)3 với dung dịch HCl và rút ra nhận xét :
Áp dụng định luật bảo toàn khối lượng, ta có :
m2 muối cacbonat + maxit = m2 muối clorua + mCO2 + mH2O
m2 muối clorua = 10 + (0,03 x 2 x 36,5) - (0,03 x 44) - (0,03 x 18) = 10,33 (gam)
Cách 2 : Áp dụng phương pháp tăng giảm khối lượng
Viết phương trình hoá học của XCO3 và Y2(CO3)3 với dung dịch HCl, ta nhận thấy khi chuyển từ muối cacbonat thành muối clorua thì cứ 1 mol CO2 bay ra thì khối lượng tăng : 71 - 60 = 11 (gam)
0,03 mol CO2 bay ra thì khối lượng tăng : 0,03 x 11 gam
Tổng khối lượng muối clorua tạo thành :
10 + (0,03 x 11)= 10,33 (gam)
Bài 32.19 trang 42 SBT Hóa học 9: Thể tích khí clo cần phản ứng với kim loại M bằng 1,5 lần lượng khí sinh ra khi cho cùng lượng kim loại đó tác dụng hoàn toàn với dung dịch axit HCl dư trong cùng điều kiện. Khối lượng muối clorua sinh ra trong phản ứng với clo gấp 1,2886 lần lượng sinh ra trong phản ứng với axit HCl. Xác định kim loại M
Phương pháp giải:
Gọi hóa trị của M là m và n, biện luận tìm m và n theo dữ kiện và PTHH.
Lời giải:
Phương trình hóa học của phản ứng:
Theo đề bài, ta có:
và M + 106,5 = 1,2886 (M+71)
Giải ra, ta có M = 52 (Cr)
Bài 32.20 trang 42 SBT Hóa học 9: X, Y là hai nguyên tố halogen thuộc hai chu kì liên tiếp trong bảng tuần hoàn. Hỗn hợp A chứa 2 muối X, Y với natri. Để kết tủa hoàn toàn 2,2 gam hỗn hợp A phải dùng 150 ml dung dịch AgNO3 0,2M. Xác định hai nguyên tố X và Y.
Phương pháp giải:
Viết PTHH, dựa vào PTHH và bảng tuần hoàn để biện luận tìm X và Y.
Lời giải:
NaX + AgNO3 ----> NaNO3 + AgX
a mol a mol a mol a mol
NaY + AgNO3 -----> NaNO3+ AgY
b mol b moi b mol b mol
Áp dụng định luật bảo toàn khối lượng, ta có :
2,2 + 5,1 = 2,55 + mkết tủa ---> mkết tủa = 4,75 (gam)
(108 + X)a + (108 + Y)b = 4,75 ; a + b = 0,03 (mol)
Xa + Yb + 15,1. Cho X > Y ; Xa + Xb > Xa + Yb > Ya + Yb
X và Y là các halogen liên tiếp, vậy đó là brom (80) và Cl (35,5).