Với giải Bài 7.4 trang 20 SBT Hóa học lớp 10 Cánh diều chi tiết trong Bài 7: Xu hướng biến đổi một số tính chất của đơn chất, biến đổi thành phần và tính chất của hợp chất trong một chu kì và trong một nhóm giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập trong SBT Hóa học 10. Mời các bạn đón xem:
Giải sách bài tập Hóa học lớp 10 Bài 7: Xu hướng biến đổi một số tính chất của đơn chất, biến đổi thành phần và tính chất của hợp chất trong một chu kì và trong một nhóm
Bài 7.4 trang 20 sách bài tập Hóa học 10: Cho bảng số liệu sau đây:
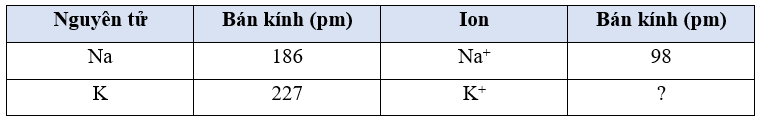
Dựa trên xu hướng biến đổi tuần hoàn và dữ liệu trong bảng trên, giá trị nào sau đây là phù hợp nhất với bán kính ion K+?
A. 90 pm.
B. 133 pm.
C. 195 pm.
D. 295 pm.
Lời giải:
Đáp án đúng là: B
Các cation luôn có bán kính nhỏ hơn đáng kể so với nguyên tử trung hòa tương ứng do có số lượng electron ít hơn, lực hút của hạt nhân lên các electron mạnh hơn, do vậy bán kính của K+ phải nhỏ hơn bán kính của K (227 pm).
Bên cạnh đó, theo xu hướng biến đổi tuần hoàn thì bán kính của K+ phải lớn hơn bán kính của Na+ (98 pm), tương tự như bán kính của K lớn hơn của Na.
Trong hai giá trị 133 và 195 pm, giá trị 133 pm phù hợp hơn vì thể hiện sự giảm đáng kể bán kính cation so với nguyên tử trung hòa, tương tự trường hợp Na và Na+ trong bảng số liệu.
Xem thêm các lời giải sách bài tập Hóa học lớp 10 Cánh diều hay, chi tiết khác:
Bài 7.1 trang 20 sách bài tập Hóa học 10:Chọn nguyên tử có bán kính lớn hơn trong mỗi cặp nguyên tử nguyên tố sau:...
Bài 7.2 trang 20 sách bài tập Hóa học 10: Dãy nguyên tử nào sau đây có bán kính tăng dần?...
Bài 7.3 trang 20 sách bài tập Hóa học 10: Dãy các ion nào sau đây có bán kính tăng dần?...
Bài 7.5 trang 20 sách bài tập Hóa học 10: Phát biểu nào sau đây là đúng về xu hướng biến đổi tính kim loại trong bảng tuần hoàn các nguyên tố hóa học?...
Bài 7.6 trang 21 sách bài tập Hóa học 10: Chọn nguyên tố thể hiện tính kim loại nhiều hơn trong mỗi cặp nguyên tố sau:...
Bài 7.7 trang 21 sách bài tập Hóa học 10: Dãy các nguyên tố nào sau đây có tính kim loại giảm dần?...
Bài 7.8 trang 21 sách bài tập Hóa học 10: Xu hướng biến đổi độ âm điện của các nguyên tố trong bảng tuần hoàn tương tự như xu hướng biến đổi của yếu tố nào sau đây?...
Bài 7.9 trang 21 sách bài tập Hóa học 10: Cấu hình electron nào sau đây ứng với nguyên tố có độ âm điện lớn nhất?...
Bài 7.10 trang 21 sách bài tập Hóa học 10:Điền kí hiệu hoá học hoặc cụm từ thích hợp vào chỗ trống trong đoạn thông tin sau:...
Bài 7.11 trang 21 sách bài tập Hóa học 10: Trong liên kết H-X (với X là F, Cl, Br), cặp electron trong liên kết sẽ bị lệch về nguyên tử X do chúng có độ âm điện lớn hơn H. Hãy sắp xếp các nguyên tử X theo chiều giảm dần mức độ lệch của cặp electron liên kết về phía nó...
Bài 7.12 trang 22 sách bài tập Hóa học 10:Phân loại các oxide sau đây dựa trên tính acid – base: Na2O, MgO, Al2O3, P2O5, SO3, Cl2O7...
Bài 7.13 trang 22 sách bài tập Hóa học 10: Những oxide nào sau đây tạo ra môi trường acid khi cho vào nước?...
Bài 7.14 trang 22 sách bài tập Hóa học 10:Ghép từng nhóm đặc điểm ở cột A với một phần tử tương ứng trong cột B....
Bài 7.15 trang 22 sách bài tập Hóa học 10:Khi phát minh ra bảng tuần hoàn, ngoài việc sắp xếp các nguyên tố đã biết, Mendeleev còn dự đoán sự tồn tại của một số nguyên tố chưa được biết tới thời đó. Chẳng hạn, nguyên tố nhóm III (nhóm IIIA trong bảng tuần hoàn hiện đại) ngay liền dưới nhôm được Mendeleev gọi là eka-nhôm (eka - aluminium), với kí hiệu là Ea (eka là từ tiếng Phạn có nghĩa là “đầu tiên”; do đó eka-nhôm là nguyên tố đầu tiên dưới nhôm). Dựa trên những tính chất của nhôm, em hãy dự đoán một số thông tin của nguyên tố eka-nhôm: số electron lớp ngoài cùng, công thức oxide cao nhất, công thức hydroxide và tính acid – base của chúng...
Bài 7.16 trang 22 sách bài tập Hóa học 10: Xét hai nguyên tố X và Y. Nguyên tố X có độ âm điện lớn hơn nguyên tố Y...
Bài 7.17 trang 23 sách bài tập Hóa học 10: Một kim loại M phản ứng mãnh liệt với nước tạo thành dung dịch MOH. Nếu M là nguyên tố chu kì 4, hãy viết cấu hình electron của M...
Xem thêm các bài giải SBT Hoá học lớp 10 Cánh diều hay, chi tiết khác:
Bài 6: Cấu tạo của bảng tuần hoàn các nguyên tố hóa học
Bài 7: Xu hướng biến đổi một số tính chất của đơn chất, biến đổi thành phần và tính chất của hợp chất trong một chu kì và trong một nhóm
Bài 8: Định luật tuần hoàn và ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
Bài 9: Quy tắc octet
Bài 10: Liên kết ion