Với giải Bài 5.12 trang 15 SBT Hóa học lớp 10 Cánh diều chi tiết trong Bài 5: Lớp, phân lớp và cấu hình electron giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập trong SBT Hóa học 10. Mời các bạn đón xem:
Giải sách bài tập Hóa học lớp 10 Bài 5: Lớp, phân lớp và cấu hình electron
Bài 5.12 trang 15 sách bài tập Hóa học 10: Cấu hình electron của một nguyên tử được biểu diễn dưới dạng các ô orbital như sau:
Số electron hóa trị và tính chất đặc trưng của nguyên tố hóa học này là
A. 3, tính kim loại.
B. 5, tính phi kim.
C. 7, tính phi kim.
D. 4, tính kim loại.
Lời giải:
Đáp án đúng là: B
Dựa vào cấu hình electron theo orbital ta có cấu hình electron nguyên tử như sau:
1s22s22p3.
Vậy nguyên tử có 5 electron hóa trị, là phi kim (do có 5 electron ở lớp ngoài cùng).
Các nguyên lý và quy tắc phân bố electron trong nguyên tử
a/ Nguyên lý Pauli: Trên 1 obitan có tối đa 2e và 2e này chuyển động tự quay khác chiều nhau:
1 obitan có 2e: 2e 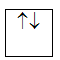
1 obitan có 1e: 1e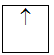
b/ Nguyên lý vững bền: Ở trạng thái cơ bản, trong nguyên tử các electron chiếm lần lượt các obitan có mức năng lượng từ thấp đến cao.
c/ Quy tắc Hund: Trong 1 phân lớp, các electron sẽ phân bố trên các obitan sao cho số electron độc thân là tối đa và có chiều tự quay giống nhau.
Ví dụ:
d/ Trật tự các mức năng lượng nguyên tử: Trong nguyên tử, các electron trên các obitan khác nhau, nhưng cùng 1 phân lớp có mức năng lượng như nhau. Các mức năng lượng nguyên tử tăng dần theo trình tự:
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p
Cấu hình electron nguyên tử biểu diễn sự phân bố electron trên các phân lớp của các lớp electron khác nhau.
a/ Cách viết cấu hình electron nguyên tử
- Xác định số electron trong nguyên tử.
- Phân bố các electron theo trật tự mức năng lượng AO tăng dần.
- Viết cấu hình electron theo thứ tự các phân lớp electron trong một lớp.
b/ Đặc điểm của lớp electron ngoài cùng
- Các electron lớp ngoài cùng quyết định tính chất hóa học của một nguyên tố.
- Số electron lớp ngoài cùng tối đa là 8e
+ Các nguyên tử kim loại có: 1e, 2e, 3e lớp ngoài cùng.
+ Các nguyên tử phi kim có: 5e, 6e, 7e lớp ngoài cùng.
+ Các nguyên tử khí hiếm có: 8e (He có 2e) lớp ngoài cùng.
+ Các nguyên tử có 4e lớp ngoài cùng có thể là kim loại (Ge, Sn, Pb) có thể là phi kim (C, Si).
Xem thêm các lời giải sách bài tập Hóa học lớp 10 Cánh diều hay, chi tiết khác:
Bài 5.1 trang 12 sách bài tập Hóa học 10:Phát biểu nào sau đây là đúng?...
Bài 5.2 trang 13 sách bài tập Hóa học 10:Phát biểu nào sau đây không đúng?...
Bài 5.3 trang 13 sách bài tập Hóa học 10:Mỗi phát biểu sau đây là đúng hay sai?...
Xem thêm các bài giải SBT Hoá học lớp 10 Cánh diều hay, chi tiết khác:
Bài 4: Mô hình nguyên tử và orbital nguyên tử
Bài 5: Lớp, phân lớp và cấu hình electron
Bài 6: Cấu tạo của bảng tuần hoàn các nguyên tố hóa học
Bài 8: Định luật tuần hoàn và ý nghĩa của bảng tuần hoàn các nguyên tố hóa học