Tailieumoi.vn giới thiệu Giải bài tập Hóa học lớp 11 Bài 39: Dẫn xuất halogen của hiđrocacbon chính xác, chi tiết nhất giúp học sinh dễ dàng làm bài tập Dẫn xuất halogen của hiđrocacbon lớp 11.
Giải bài tập Hóa học lớp 11 Bài 39: Dẫn xuất halogen của hiđrocacbon
Câu hỏi và bài tập ( trang 177 SGK Hóa học 11)
Bài 1 trang 177 SGK Hóa học 11: Gọi tên mỗi chất sau: CH3- CH2Cl; CH2 = CH- CH2Cl; CHCl3; C6H5Cl. Viết phương trình hóa học của các phản ứng điều chế mỗi chất trên từ hidrocacbon tương ứng.
Lời giải:
CH3- CH2Cl : etyl clorua (cloetan);
CH2 = CH- CH2Cl: anlyl clorua (1-cloprop- 2-en);
C6H5Cl : phenyl clorua (clobenzen)
CHCl3: clorofom (triclometan)
- Điều chế các chất trên từ hidrocacbon tương ứng:
CH3CH3 + Cl2 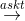 CH3- CH2Cl + HCl
CH3- CH2Cl + HCl
CH2=CH-CH3 + Cl2 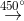 CH2 = CH- CH2Cl +HCl
CH2 = CH- CH2Cl +HCl
CH4 + 3Cl2 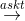 CHCl3 + 3HCl
CHCl3 + 3HCl
C6H6 + Cl2 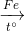 C6H5Cl + HCl
C6H5Cl + HCl
Bài 2 trang 177 SGK Hóa học 11: Viết phương trình phản ứng hóa học của phản ứng thủy phân các chất sau trong dung dịch NaOH: 1,2- đicloetan; benzyl clorua, anylyl bromua; xiclohexyl clorua.
Lời giải:
Cl-CH2-CH2-Cl + 2NaOH OH-CH2-CH2-OH + 2NaCl
C6H5-CH2-Cl + NaOH C6H5-CH2-OH + NaCl
CH2=CH-CH2-Br + NaOH CH2=CH-CH2-OH + NaBr
C6H11-Cl + NaOH C6H11-OH + NaCl
Bài 3 trang 177 SGK Hóa học 11: Cho nhiệt độ sôi (0C) của một số dẫn xuất halogen trong bảng dưới đây:
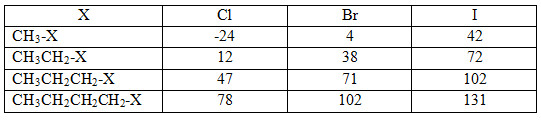
Nhận xét về sự biến đổi nhiệt độ sôi theo chiều tăng mạch cacbon (theo hàng dọc) và theo nguyên tử khối của halogen (hàng ngang). Giải thích sơ bộ.
Lời giải :
- Theo chiều ngang khi cùng mạch cacbon, các nguyên tử khối của các halogen tăng dần dẫn đến nhiệt độ sôi cũng tăng dần.
- Theo chiều dọc khi mạch cabon tăng (cùng nguyên tố halogen) thì nhiệt độ sôi của các chất cũng tăng dần.
Nguyên nhân là do: khi nguyên tử khối của các chất tăng dần cần tốn nhiều năng lượng để chuyển các phân tử hữu cơ sang trạng thái hơi nhiệt độ sôi tăng.
Bài 4 trang 177 SGK Hóa học 11: Từ axetilen, viết phương trình hóa học của các phản ứng điều chế: etyl bromua(1); 1,2- đibrometan (2); vinyl clorua (3); 1,1- đibrometan (4).
Phương pháp giải :
(1) C2H2 C2H6 C2H5Br
(2) C2H2 → C2H4 CH2Br- CH2Br
(3) C2H2 C2H3Cl
(4) C2H2 CH2=CHBr CH3CHBr2
Lời giải :
(1) điều chế etyl bromua
CH≡CH + H2 C2H6
CH3-CH3 + Br2 CH3-CH2-Br + HBr
(2) điều chế 1,2-đibrometan
CH≡CH + H2 CH2=CH2
CH2=CH2 + Br2 → CH3Br – CH3Br
(3) điều chế vinyl clorua
CH≡CH + HCl CH2=CH-Cl
(4) điều chế 1,1 –đibrometan
CH≡CH + HBr CH2=CHBr
CH2=CHBr + HBr CH3CHBr2
Bài 5 trang 177 SGK Hóa học 11: Dùng hai ống nghiệm, mỗi ống đựng 1ml một trong hai chất lỏng sau: etylbromua (1); brombenzen (2).
Thêm tiếp vào mỗi ống 1 ml dung dịch AgNO3. Đun sôi hai ống nghiệm, thấy ở ống 1 có kết tủa vàng nhạt, trong khi đó ở ống 2 không có hiện tượng gì. Nhận xét và giải thích các hiện tượng ở thí nghiệm trên.
Phương pháp giải:
Liên kết C-Br trong etylbromua kém bền hơn trong liên kết C-Br gắn trực tiếp vào vòng benzen.
Do vậy ở etylbromua có phản ứng tạo ra AgBr↓vàng còn brombezen thì không có phản ứng.
Lời giải :
Ống (1) có phản ứng:
CH3 – CH2Br + H2O CH3- CH2OH + HBr
AgNO3 + HBr → AgBr↓vàng + HNO3
Ống (2) không có phản ứng
Nhận xét: Chứng tỏ liên kết C- Br trong brombenzen rất bền, liên kết C-Br trong etylbromua kém bền hơn.
Bài 6 trang 177 SGK Hóa học 11: Khi đun nóng etyl clorua trong dung dịch chứa KOH và C2H5OH, thu được
A. Etanol
B. Etilen
C. Axetilen
D. Etan
Lời giải :
CH3CH2-Cl + KOH CH2=CH2 + KCl + H2O
Đáp án B
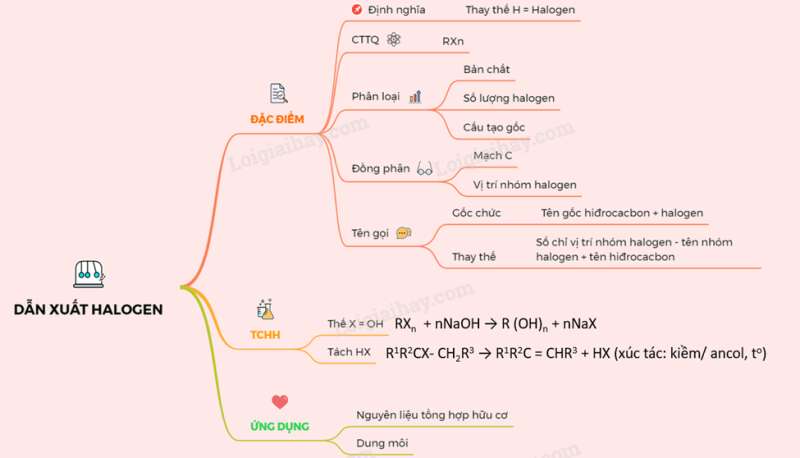
I. ĐỊNH NGHĨA, ĐỒNG PHÂN, DANH PHÁP
- Định nghĩa: Khi thay thế nguyên tử hiđro của phân tử hiđrocacbon bằng nguyên tử halogen ta được dẫn xuất halogen của hiđrocacbon
- Công thức tổng quát: RXn
- Phân loại: theo bản chất, số lượng nguyên tử halogen và đặc điểm cấu tạo gốc hiđrocacbon
- Bậc của dẫn xuất halogen = bậc C liên kết với X
- Đồng phân: gồm đồng phân mạch cacbon và đồng phân vị trí X
- Tên gọi:
+ Tên gốc – chức: Tên gốc hiđrocacbon + halogen
+ Tên thay thế: Số chỉ vị trí nhóm halogen - tên nhóm halogen + tên hiđrocacbon .
II. TÍNH CHẤT HÓA HỌC
1. Phản ứng thế nguyên tử halogen X bằng nhóm OH
PTTQ:
RXn + nNaOH R (OH)n + nNaX
2. Phản ứng tách HX
R1R2CX- CH2R3 → R1R2C = CHR3 + HX (xúc tác: kiềm/ ancol, to)
III. ỨNG DỤNG
- Làm nguyên liệu cho tổng hợp hữu cơ
- Làm dung môi và nhiều ứng dụng quan trọng khác
Sơ đồ tư duy: Dẫn xuất halogen của hidrocacbon